
2022-10-26 09:59:07來源:藥智網瀏覽量:606
人類遺傳資源辦公室(以下簡稱“遺傳辦”)對臨床研究進展影響重大,申辦方或CRO或設置專門團隊應對遺傳辦審批。
這與近年醫藥企業管線策略相關,“要走出去,也要請進來”,全球多中心臨床研究廣泛開展和藥企出海正成為一種流行,這似乎是中國醫藥企業發展壯大的必經之路。
近日,根據2022年遺傳辦公布的數據,TOP10 CRO最愛服務的申辦方藥企出爐!羅氏、禮來、武田等企業上榜。
TOP10 CRO最愛服務的申辦方藥企
據統計,遺傳辦臨床研究申請最有經驗的10家CRO為:
艾昆緯、泰格、昆翎、徠博科、康德弘翼、百時益、精鼎、諾思格、科林利康、昆拓,這或許也是中國十大CRO企業。
1.艾昆緯臨床研究訂單高度集中、項目高端。
其研究來源前四位,均為TOP外資申辦方,羅氏、禮來、默克雪蘭諾和武田,這四家研究占其總研究數50%,其中羅氏一家就占比30%,由此可見艾昆緯在腫瘤研究領域的優勢。
2.泰格研究來源最分散且健康。
泰格國內臨床研究“老大哥”地位毋庸置疑,遺傳辦研究數量排名第二的泰格,以29家申辦方數量占比其研究總數50%,成為訂單來源最分散的CRO,足以說明泰格的品牌影響力巨大,受眾多申辦方青睞。
3.昆翎更鐘情Biotech。
昆翎臨床研究數量前五位申辦方均為Biotech,上海海和、嘉和生物、神州細胞等,隨著資本市場預冷,Biotech公司融資困難,昆翎的客戶畫像是否需要重新描繪?
4.徠博科助力傳統大Pharma。
海思科是通過新藥研發在傳統藥企轉型為創新藥企,較為成功的案例之一。其自主研發1.1類新藥環丙泊酚商業化后,獲得快速增長,企業市值在二級市場穩中有進。
5.康德弘翼不靠外企依然是巨無霸。
在康德弘翼研究申請前五位申辦方,鮮有外資申辦方(除羅氏診斷)。
6.百時益充分掌握“二八原則”。
50%遺傳辦研究申請來源于武田制藥,而武田制藥近年新藥研發進展較快,在其4年前合并夏爾后已經妥妥成為全球十大藥企。
7.排名第七位精鼎,以外企申辦方藥企為主,在精神領域領先的優時比申請最多。
8.排名第八的賽紐仕,服務一家申辦方撐起“半邊天”。
9.排名第九、十位CRO諾思格、科林利康,在國內研究合同組織合作重點,為國內申辦方。
TOP 19 CRO占遺傳辦研究申請一半
在中國很少有關于CRO訂單數據,從遺傳辦發布數據可見一斑。
2022年1-10月19家CRO研究申請數量占比50%,88家CRO研究申請數量占比80%,5%的CRO企業貢獻50%研究數量。
換句話講,對于需要遺傳辦審批的臨床研究更加集中在國內龍頭CRO和跨國CRO企業(見圖1)。
艾昆緯和泰格屬于第一梯隊,遠遠超過其他CRO,昆翎、康德弘翼和諾思格也有不俗表現,一定程度上說明其在臨床研究領域的江湖地位。
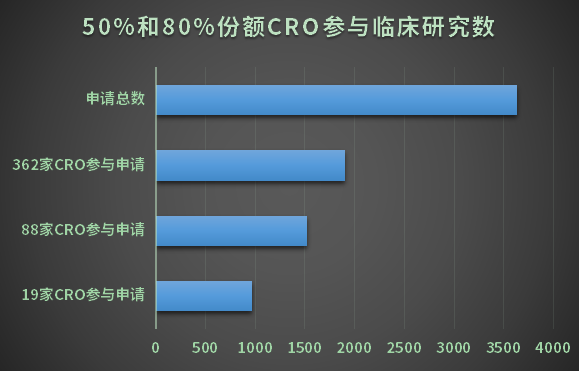
圖1 50%和80%份額CRO參與研究數
與申辦方藥企不同,外資背景CRO并不占有優勢,從龍頭CRO看,艾昆緯、泰格和昆翎分別為遺傳辦研究申請前三位。從19家CRO數量看,外資CRO也并未體現其數量優勢。
事實上,在中國進行臨床研究,具有內資背景的CRO占有較大優勢,熟悉政策環境,對PI的支持度更大,與機構合作良好;需要加強方面是標準化和系統化,畢竟最早的內資CRO成立也不過20多年。
在研究經驗和體系化方面,還需要向數十年經驗的國外CRO學習。
當然,國內也有體系化不錯的CRO,例如昆翎在2021年更名之后,開啟更快征程,2022年7月宣布完成1.5億美元融資,將致力于中國以及海外持續擴張、創新業務發展以及兼并收購。
CRO仍然是臨床研究主力
藥企管線布局要考慮未被滿足治療需求,更要考慮商業化的未來,后者逐漸使新藥研發與投資理性。
中國創新藥發展迅猛,是全球多中心臨床研究是全球化布局的重要一環,這也導致遺傳辦申請結果熾手可熱。
據有關數據顯示,截止2022年10月遺傳辦公布國際合作科學研究項目19批次,共計3632項,平均每月審批300多項,日均審批16.5項(見圖2)。
而遺傳辦對臨床研究申請審批有嚴格流程和步驟,盡管早在2021年為加速審批速度,曾簡化審批流程,但如今看來,旺盛的研發需求對審批依然帶來巨大挑戰。
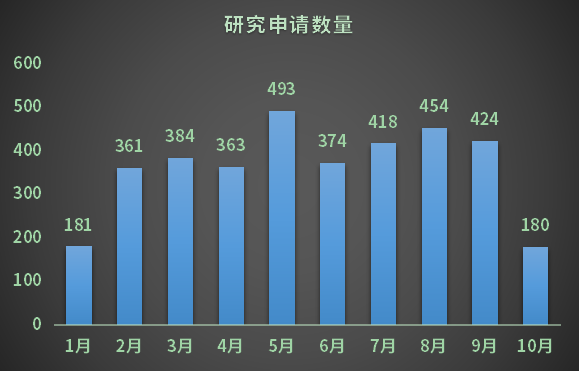
圖2 研究申請數量
3632項研究中CRO參與申請占52%,比重超過一半,依然是臨床研究領域主力軍(見圖3)。
另一方面,我們可以看到,很大一部分申辦方選擇自建臨床研究團隊,可能有幾個考量,一是國內大Pharma研發管線豐盈,自建隊伍可以降本增效,例如齊魯制藥、正大天晴;
二是自建團隊對于臨床研究進度可控;三是部分小型藥企沒有能力付費給CRO高額研究費,因而選擇自己“硬”上。
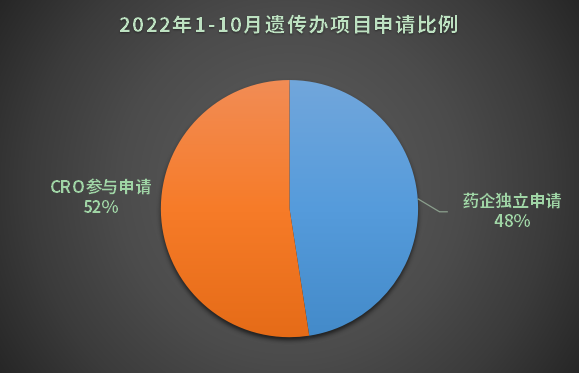
圖3 2022年1-10月遺傳辦項目申請比例
雖然申辦方選擇自建隊伍,但這并不是趨勢,從國外大藥企持續選擇研究訂單外包,可略知一二。
一方面,申辦方自營的臨床研究隊伍,研究效率低于外包CRO;另一方面,自建臨床研究團隊需要企業擁有經營戰略清晰、可持續的能力。
從全球頭部CRO數十年的經驗看,中國的CRO屬于起步階段,在相當長一段時間仍然會成為臨床研究的重要力量。
小結
中國CRO起步較晚,隨著醫藥工業升級需求,新藥研發才逐漸嶄露頭角。
一方面,在2015年以后創新藥申請大幅度上升,才促進CRO數量的井噴,一定程度促進中國CRO的發展。
另一方面,臨床研究組織訂單數據相對匱乏,遺傳辦發布數據具有一定借鑒參考意義。
參考資料:2022年1月-10月遺傳辦公布數據
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容