
2022-11-14 15:12:49來源:藥智網(wǎng)瀏覽量:251
本期(11月4日至11月11日),首款國產(chǎn)高選擇性PI3Kδ抑制劑獲批上市,國產(chǎn)門冬胰島素30注射液迎來第三家,K藥適應(yīng)癥再次拓展,箕星藥業(yè)4億美元引進的心衰新藥國內(nèi)申報上市,更多動態(tài)如下:
國內(nèi)審評審批·新動態(tài)
本期CDE有37個受理號(32個品種)報生產(chǎn)辦理狀態(tài)更新,其中瓔黎藥業(yè)的林普利塞片、東陽光藥的門冬胰島素30注射液、以及默沙東的帕博利珠單抗注射液備受關(guān)注。更多動態(tài)如下:
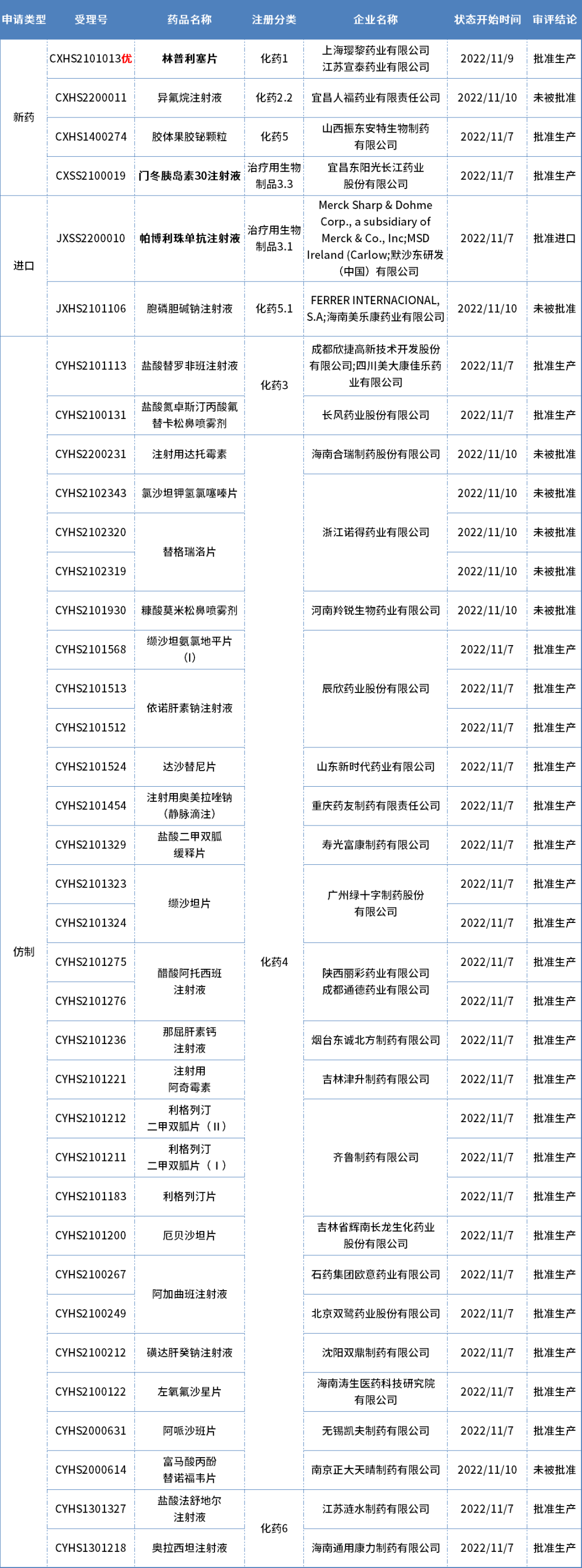
數(shù)據(jù)來源:藥智數(shù)據(jù)
恒瑞/瓔黎藥業(yè)重磅1類新藥獲批上市
日前,國家藥監(jiān)局通過優(yōu)先審評審批程序附條件批準(zhǔn)上海瓔黎藥業(yè)的1類創(chuàng)新藥林普利塞片(linperlisib,商品名:因他瑞)上市,適用于既往接受過至少兩種系統(tǒng)性治療的復(fù)發(fā)或難治濾泡性淋巴瘤成人患者。這是我國首個獲批上市的高選擇性PI3Kδ抑制劑,也是恒瑞醫(yī)藥BD領(lǐng)域首個獲批上市的創(chuàng)新藥。
林普利塞由上海瓔黎藥業(yè)研發(fā),恒瑞醫(yī)藥于2021年2月對瓔黎藥業(yè)進行2000萬美元股權(quán)投資(占總股本6.67%),并獲得了林普利塞在大中華地區(qū)的聯(lián)合開發(fā)權(quán)益以及排他性獨家商業(yè)化權(quán)益。
此前,林普利塞曾獲得NMPA頒發(fā)的用于治療R/R FL的突破性療法認(rèn)定,以及美國FDA頒發(fā)的FL、慢性淋巴細(xì)胞白血病/小淋巴細(xì)胞淋巴瘤(CLL/SLL)和T細(xì)胞淋巴瘤適應(yīng)癥的三項孤兒藥資格認(rèn)定。在2022年公布的林普利塞治療R/R FL患者的中國II期臨床試驗最新數(shù)據(jù)顯示,林普利塞治療R/R FL患者的有效率接近百分之八十,并表現(xiàn)出可控的安全性。
不過,近幾年來,靶向PI3K的藥物暴露出越來越多的安全性問題,多個藥物因安全性問題引發(fā)退市或者放棄上市申請,僅僅在2022年,就有包括Incyte公司、MEI Pharma公司、TG Therapeutics等三家公司的PI3K藥物被FDA拒絕上市或者主動放棄上市申請。此次在中國獲批的林普利塞,大概率是近期全球范圍內(nèi)唯一上市的PI3K抑制劑藥物。
東陽光藥門冬胰島素30注射液獲批上市
日前,東陽光藥的門冬胰島素30注射液獲NMPA批準(zhǔn)上市。藥智數(shù)據(jù)顯示,這是第三款獲批的國產(chǎn)門冬胰島素30注射液,另兩款分別來自甘李藥業(yè)和珠海聯(lián)邦制藥,此外,通化東寶、吉林惠升生物也已提交上市申請。
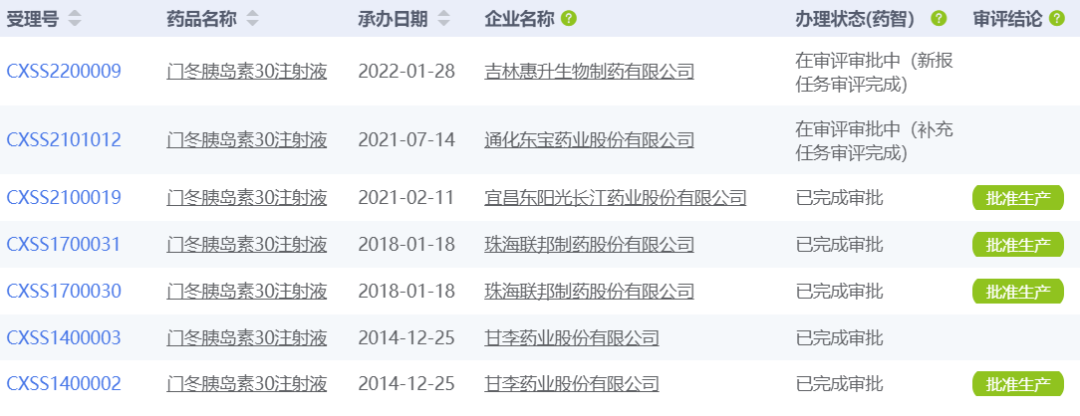
數(shù)據(jù)來源:藥智數(shù)據(jù)
門冬胰島素是諾和諾德研發(fā)的短效胰島素類似物,門冬胰島素30注射液是第三代預(yù)混胰島素類似物,含30%可溶性門冬胰島素和70%精蛋白門冬胰島素,適用于糖尿病的治療,可臨餐注射,其糖化血紅蛋白(HbA1c)達標(biāo)率更高,能同時更好的控制空腹和餐后血糖,在改善血糖控制、減少低血糖風(fēng)險、提高依從性以及節(jié)約醫(yī)療成本方面優(yōu)勢明顯,更適合低血糖感知受損的高危患者。
默沙東PD-1在華獲批第10項適應(yīng)癥
近日,默沙東PD-1抑制劑帕博利珠單抗(商品名:可瑞達??)一項新適應(yīng)癥獲NMPA批準(zhǔn),聯(lián)合化療新輔助治療并在手術(shù)后繼續(xù)帕博利珠單抗單藥輔助治療,用于經(jīng)充分驗證的檢測評估腫瘤表達PD-L1(綜合陽性評分(CPS)≥20)的早期高危三陰性乳腺癌(TNBC)患者的治療。
這是帕博利珠單抗在中國獲批的第10個適應(yīng)證:
①二線治療晚期黑色素瘤
②一線治療PD-L1表達≥1%、無EGFR/ALK突變的晚期NSCLC
③聯(lián)合化療一線治療無EGFR/ALK突變的晚期非鱗NSCLC
④聯(lián)合化療一線治療晚期鱗狀NSCLC
⑤二線治療食管癌
⑥一線治療CPS≥20的晚期頭頸鱗癌
⑦一線治療MSI-H/dMMR結(jié)直腸癌
⑧一線治療食管癌
⑨二線治療肝細(xì)胞癌
⑩一線治療CPS≥20的早期高危三陰性乳腺癌(TNBC)
國內(nèi)審評審批·新受理
本期CDE新增報生產(chǎn)受理號88個,共60個品種,其中卓和藥業(yè)的風(fēng)葉咳喘平口服液和箕星藥業(yè)引進的Omecamtiv Mecarbil緩釋片備受關(guān)注,更多動態(tài)見下表:
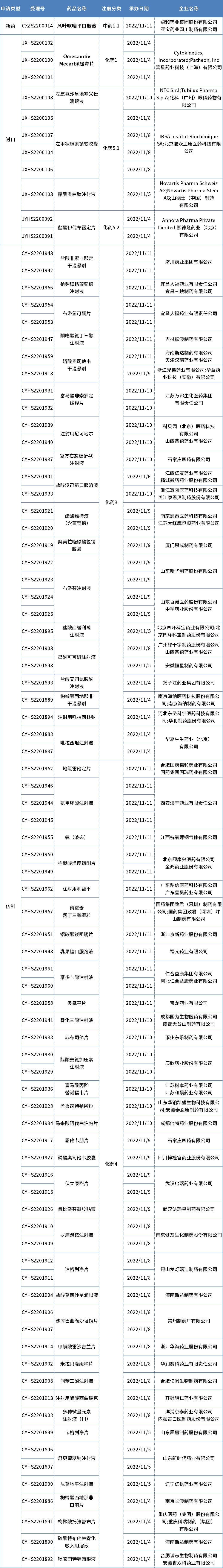
數(shù)據(jù)來源:藥智數(shù)據(jù)
卓和藥業(yè)/亞寶藥業(yè)1.1類中藥報上市
風(fēng)葉咳喘平口服液是由卓和藥業(yè)集團股份有限公司與亞寶藥業(yè)四川制藥有限公司開發(fā)一款1.1類中藥,用于治療急性支氣管炎咳嗽。
近年來,國家持續(xù)發(fā)布中醫(yī)藥戰(zhàn)略發(fā)展利好政策,自2020版中藥注冊分類(2020年7月1日起實施)實施以來,已有多款1類中藥創(chuàng)新藥申報上市,其中9款已獲批上市,8款還在審評審批中。
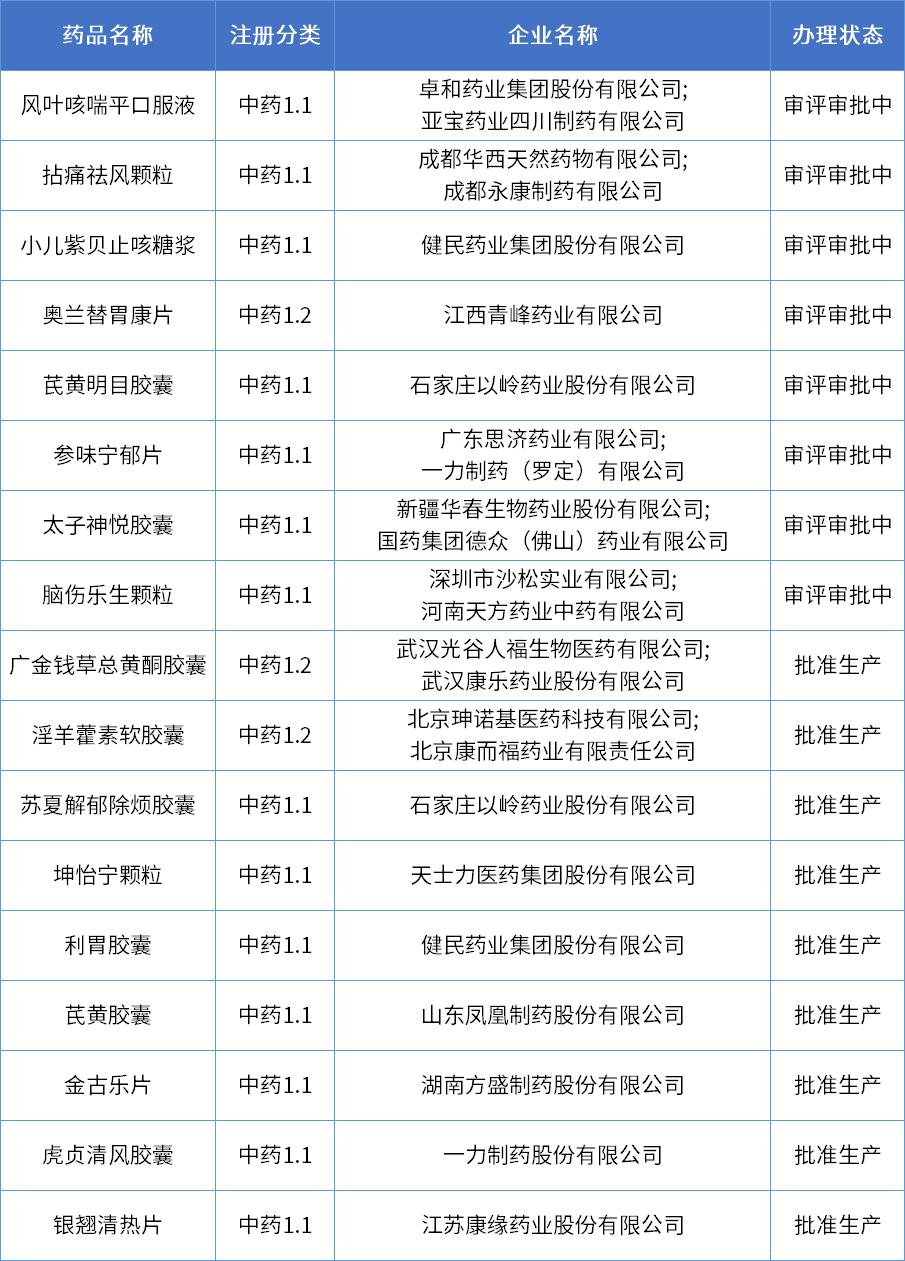
數(shù)據(jù)來源:藥智數(shù)據(jù)
箕星藥業(yè)引進的1 類心衰新藥申報上市
藥智數(shù)據(jù)顯示,箕星藥業(yè)/Cytokinetics提交的omec amtiv mecarbil緩釋片申報上市已獲受理,用于治療射血分?jǐn)?shù)降低的心力衰竭(HFrEF)。該藥由箕星藥業(yè)從Cytokinetics公司引進,箕星藥業(yè)擁有omecamtiv mecarbil治療射血分?jǐn)?shù)降低的心力衰竭(HFrEF)這一擬定適應(yīng)癥在大中華區(qū)的開發(fā)和商業(yè)化權(quán)力,Cytokinetics公司獲得7000萬美元的承諾資金,以及有資格從箕星藥業(yè)獲得最高3.3億美元的額外里程碑付款。
據(jù)箕星藥業(yè)新聞稿,omecamtiv mecarbil是一種首創(chuàng)選擇性小分子心肌肌球蛋白激活劑在研新藥,旨在增加每個心動周期中的活性肌動蛋白-肌球蛋白橫橋數(shù)量,從而在射血分?jǐn)?shù)降低的心力衰竭(HFrEF)患者中增強受損的心肌收縮力。
今年2月,美國FDA受理了omecamtiv mecarbil的新藥上市申請,PDUFA日期為2022年11月30日。本次該藥上市申請獲CDE受理,意味著該藥也將給國內(nèi)心衰患者帶來更多治療選擇。
數(shù)據(jù)來源:藥智數(shù)據(jù)、企業(yè)公告等網(wǎng)絡(luò)公開數(shù)據(jù)
信息來源:藥智網(wǎng)、企業(yè)公告等網(wǎng)絡(luò)公開信息
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容