今日(11月15日),中國國家藥監局藥品審評中心(CDE)官網公示,恒瑞醫藥的馬來酸吡咯替尼片的新適應癥上市申請擬被納入優先審評,擬用于治療HER2陽性、晚期階段未接受過抗HER2治療的復發或轉移性乳腺癌患者,即一線治療HER2陽性復發/轉移性乳腺癌患者。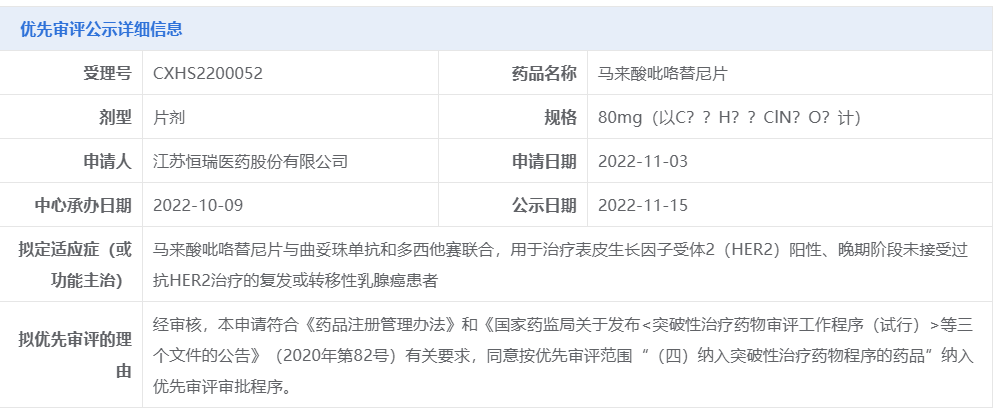
截圖來源:CDE官網
馬來酸吡咯替尼片是恒瑞醫藥自主研發的一款口服HER1/HER2/HER4酪氨酸激酶抑制劑。作為一種小分子、不可逆、泛ErbB受體酪氨酸激酶抑制劑,吡咯替尼通過阻止腫瘤細胞內表皮生長因子(EGFR)和人表皮生長因子受體2(HER2)的同質和異質二聚體形成,抑制其自身的磷酸化,阻斷下游信號通路的激活,從而抑制腫瘤細胞生長。2018年,吡咯替尼憑借2期臨床研究數據獲中國國家藥監局(NMPA)附條件批準上市。2020年,吡咯替尼憑借兩項3期研究(PHENIX、PHOEBE)結果獲得NMPA完全批準上市,聯合卡培他濱用于HER2陽性、接受過曲妥珠單抗的復發或轉移性乳腺癌患者的治療。2022年5月,吡咯替尼獲批第二個適應癥,與曲妥珠單抗和多西他賽聯合用于HER2陽性早期或局部晚期乳腺癌患者的新輔助治療。吡咯替尼本次擬被納入優先審評的上市申請針對的是一項新適應癥:馬來酸吡咯替尼片與曲妥珠單抗和多西他賽聯合,用于治療表皮生長因子受體2(HER2)陽性、晚期階段未接受過抗HER2治療的復發或轉移性乳腺癌患者。2022年8月,恒瑞醫藥宣布吡咯替尼聯合曲妥珠單抗和多西他賽在一線治療HER2陽性復發/轉移性乳腺癌的3期臨床中達到主要終點。這是一項名字為HR-BLTN-III-MBC-C的隨機、雙盲、平行對照、多中心的3期臨床試驗,旨在評價吡咯替尼聯合曲妥珠單抗和多西他賽一線治療HER2陽性復發/轉移性乳腺癌的療效和安全性,對照組為安慰劑聯合曲妥珠單抗和多西他賽。該研究由中國醫學科學院腫瘤醫院徐兵河院士擔任主要研究者,全國40家中心共同參與。該試驗共入組590例受試者。試驗主要研究終點是研究者評估的無進展生存期(PFS),次要研究終點包括獨立影像評估委員會(IRC)評估的PFS、總生存期(OS)、總緩解率(ORR)、臨床獲益率(CBR)、客觀緩解持續時間(DOR)和安全性。根據恒瑞醫藥新聞稿,在開展方案預設的期中分析時,由獨立數據監查委員會(IDMC)判定主要研究終點PFS達到方案預設的優效標準。試驗數據顯示,對于復發/轉移階段未接受過任何系統抗腫瘤治療的HER2陽性乳腺癌患者,與安慰劑聯合曲妥珠單抗和多西他賽治療相比,吡咯替尼聯合曲妥珠單抗和多西他賽治療可顯著延長患者的PFS。根據2020年世界衛生組織國際癌癥研究機構(IARC)發布的數據,乳腺癌已成為全球第一大惡性腫瘤,是女性最常見的惡性腫瘤之一。2020年中國癌癥數據顯示,乳腺癌發病率占全身各種惡性腫瘤發病率的9.1%。目前中國乳腺癌發病率增長迅速,并且近50%患者治療后會出現復發和轉移。而HER2陽性乳腺癌約占了全部乳腺癌的20%-25%。希望恒瑞醫藥馬來酸吡咯替尼片的新適應癥上市申請早日獲批,為患者帶來新的治療選擇。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容


