
2023-01-10 11:07:06來源:藥智頭條瀏覽量:380
導讀:謹慎樂觀期待Lecanemab
近日,美國FDA宣布加速批準了衛(wèi)材/Biogen的阿爾茨海默病新藥Lecanemab,商品名為Leqembi。
該藥是一種抗β淀粉樣蛋白(Aβ)抗體,能與可溶性Aβ聚合體結合,并且促進它們的清除。新英格蘭醫(yī)學期刊在不久前才正式發(fā)表該藥的三期臨床試驗結果:在18個月時,Lecanemab減少了早期阿茲海默癥中淀粉樣蛋白的標記物,并且導致認知和功能指標的下降程度低于安慰劑,但與不良事件有關。
圖片來源:衛(wèi)材官網(wǎng)
100多年前德國精神病學家阿爾茨海默首次將一例癡呆癥與大腦中的異常沉積物聯(lián)系起來。研究人員基于這樣一個論點,即治療阿爾茲海默病需要清除這些大腦異常斑塊,這些異常斑塊由淀粉樣蛋白組成,會阻塞患者的大腦。
靶向淀粉樣蛋白的藥物在不斷的失敗之后(包括 2021年FDA批準的一款有爭議的藥物Aduhelm),名為侖卡奈單抗(lecanemab)的藥物在2022年底報告的一項大型三期臨床試驗中成為第一個明確減緩阿爾茨海默病進展的藥物,給阿爾茨海默新藥研發(fā)領域帶來了希望。
但同時,該藥也依然有很多局限性,例如特定人群使用后可能出現(xiàn)“嚴重副作用”。包括有3名患者在實驗期間出現(xiàn)腦出血癥狀,不幸死亡。
為何國內(nèi)外獲批的AD藥物爭議不斷?
這幾年國內(nèi)外治療阿爾茲海默癥的藥物新聞可以發(fā)現(xiàn)爭議不斷。
2019年11月我國藥品監(jiān)督管理局有條件批準綠谷制藥的褐藻提取物為原料制備寡糖化合物甘露特鈉(GV-971)上市,據(jù)研究報道GV-971的機理是靶向腦-腸軸,并通過調(diào)節(jié)腸道菌群的失衡和減少神經(jīng)炎癥來提高認知能力。目前該藥盒每296元;按每月4盒計算,患者用藥費用約每月1184元,平均患者每日費用接近40元。但不少業(yè)內(nèi)專家對GV-971提出質(zhì)疑,疑問包括GV-971的3期臨床試驗周期過短、效果評估依據(jù)不充分、藥物作用機理闡釋不明、試驗只有一項等方面。甚至不少有醫(yī)學背景的網(wǎng)友在知乎設置議題“如何看待GV-971進入醫(yī)保及國際3期臨床試驗停止,該藥科學性如何”,并就GV-971療效問題發(fā)出質(zhì)疑。
而隨后2021年6月,美國FDA批準了單抗藥物Aduhelm。這也是來自渤健和衛(wèi)材的阿爾茨海默病治療藥物。盡管試驗結果相互矛盾:一項大型臨床研究表明無效,而另一項研究表明在減緩認知能力下降方面有一點好處;這兩項試驗都被渤健提前終止,導致結果難以解釋。美國FDA不顧外部醫(yī)學專家小組的建議批準了該藥物。隨后該小組的三名成員隨后辭職,雪上加霜的是美國醫(yī)保機構嚴格限制了Aduhelm的報銷。導致該藥物最終停止在美國銷售。美國國會調(diào)查人員在12月得出結論,Aduhelm的批準過程“充斥著違規(guī)行為”稱FDA在評估該藥物時與制藥商過度合作。
這一次,侖卡奈單抗有哪些不同?
侖卡奈單抗是由日本衛(wèi)材和美國渤鍵聯(lián)合開發(fā)的單克隆抗體藥物。用于針對特定的淀粉樣蛋白,這種蛋白與早發(fā)遺傳性阿爾茨海默氏癥的瑞典家庭有關。
在一項包含1800名早期阿爾茨海默病患者的為期18個月的臨床試驗中,接受侖卡奈單抗治療的患者腦淀粉樣蛋白水平顯著降低。更重要的是,與接受安慰劑的一組相比,該藥物使他們的認知和功能下降速度減慢了27%。與服用安慰劑的對照組相比服用此藥的阿爾茨海默氏患者的認知能力下降有所減緩。
行為神經(jīng)學家科恩(Sharon Cohen) 博士評價道:“總體來說侖卡奈單抗在很多方面都超出了預期,因為直到現(xiàn)在我們還沒有在阿爾茨海默病臨床試驗中看到如此一致的積極結果。”
本次lecanemab在美國獲批,代表在阿爾茨海默病治療領域的又一項重要進展。
在中國,2022年12月22日,侖卡奈單抗(lecanemab)注射液的上市申請獲國家藥監(jiān)局受理,適應癥為輕度阿爾茨海默病(AD)和阿爾茨海默病引起的輕度認知障礙疾病的改善治療。
侖卡奈單抗適合哪些人群?
該藥已在早期阿爾茲海默患者中進行了測試,癥狀包括衰老引起的輕度健忘,注意力不集中,輕度認知障礙和輕度癡呆癥患者。
為獲得該藥物的臨床試驗資格,志愿者可能需要接受腦淀粉樣蛋白的檢測,超過三分之二的阿爾茨海默病患者和上千萬患有輕度認知障礙的患者中約有一半存在腦淀粉樣蛋白的跡象。腦淀粉樣蛋白PET掃描的費用可能高達7千美元。另外脊椎穿刺也是另一種檢測方法,但這種檢查有侵入性,有時還會引起疼痛,因此一些患者會回避。除此之外美國和日本有一些血液測試可以判斷大腦中是否存在淀粉樣蛋白,但這種檢測尚未通過FDA批準。不過2021年12月,日本衛(wèi)生部批準了由Sysmex Corp和衛(wèi)材開發(fā)的此類測試。
侖卡奈單抗有哪些局限?
在臨床試驗中觀察到的認知衰退減緩是顯著但微小的,并且該藥物不會阻止疾病進展。
但此藥的效果也伴隨著副作用。超過五分之一的服藥患者出現(xiàn)腦腫脹或出血。其余患者沒有上述癥狀,但有時會出現(xiàn)頭痛、視力障礙和意識模糊。值得重視的是有五人出現(xiàn)大面積腦出血。三位服用抗凝血藥物的患者在試驗臨床試驗期間死亡。刊登在新英格蘭雜志的論文顯示死亡可能和同時服用抗凝血藥物有關。
另外,衛(wèi)材表示,Leqembi在美國市場的定價為2.65萬美元/年,并不便宜。
這一靶點的競爭對手有哪些?
即將獲得批準的主要潛在競爭對手是禮來公司的多納單抗(donanemab)。
在2021年報告的一項臨床2期試驗中,多納單抗顯著降低了早期阿爾茨海默病患者的大腦淀粉樣蛋白,并將認知和功能衰退減緩了32%。該公司已在美國申請基于降低淀粉樣蛋白的新藥加速審批。目前正在進行更大規(guī)模的臨床3期試驗,應該會在近期報告結果。積極結果可能會加速此藥的獲批上市。
另外羅氏的另一種降低淀粉樣蛋白的單抗藥物甘特納姆單抗(gantenerumab)在舊金山舉行的第 15 屆阿爾茨海默病臨床試驗會議上宣告兩項大型臨床試驗失敗,藥物未能減緩認知能力下降。科學家們表示,侖卡奈單抗的成功和甘特納姆單抗的失敗。同時證明了一個觀點:即淀粉狀斑塊需要被完全清除,然后大腦才能緩慢地做出反應。
小結
阿爾茨海默病堪稱藥物研發(fā)的無底洞。據(jù)藥智網(wǎng)報道近十年來藥廠針對阿爾茲海默癥累計投入的研發(fā)費用已超6000億美金。文獻調(diào)查顯示95年以來臨床階段研發(fā)費用約為425億美元,至今已有18萬4千名患者已注冊或正在參加臨床試驗。
但實事求是地看,包括已上市的藥物在內(nèi)也只能減緩疾病進程。至今該疾病仍然無法治愈,發(fā)病機制除了主流的淀粉樣蛋白逐漸沉積和細胞內(nèi)Tau蛋白聚集導致的神經(jīng)元死亡和認知障礙,還包括多重其他假說致病機理仍無法明確。
據(jù)統(tǒng)計全球患者已超過5000萬人,預計2050年將突破1.52億人。其中65歲以上患者將達到1380萬人。當前中國有1507萬60歲及以上的癡呆患者,其中983萬人患有阿爾茲海默癥,392萬人患有血管性癡呆。132萬人患有其他形式的癡呆。我國是新發(fā)病例全球增速最快的國家之一。如此巨大的高度未滿足的臨床需求使得該領域依然挑戰(zhàn)與機會并存,數(shù)AD藥物,還看今朝。
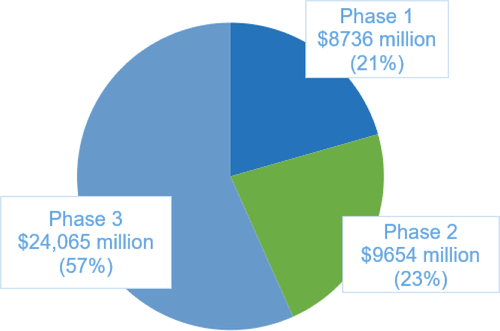
圖1 從1995年至2021年按臨床試驗階段劃分的藥物開發(fā)成本。圖源:參考資料1
參考資料:
1.開發(fā)阿爾茨海默病治療方法的成本https://alz-journals.onlinelibrary.wiley.com/doi/full/10.1002/alz.12450
2.臨床成功≠商業(yè)化成功?衛(wèi)材/渤健尋求CMS“網(wǎng)開一面” https://news1.yaozh.com/archive/37652.html
3.阿爾茨海默新藥971的爭議 https://m.huxiu.com/article/478852.html
4.阿爾茨海默藥物有助于控制癥狀https://www.mayoclinic.org/zh-hans/diseases-conditions/alzheimers-disease/in-depth/alzheimers/art-20048103
5.阿爾茨海默癥“神藥”安全性再度遭疑https://k.sina.com.cn/article_2094942911_7cde4abf019017ljy.html?from=health#/
聲明:本文系藥方舟轉載內(nèi)容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容