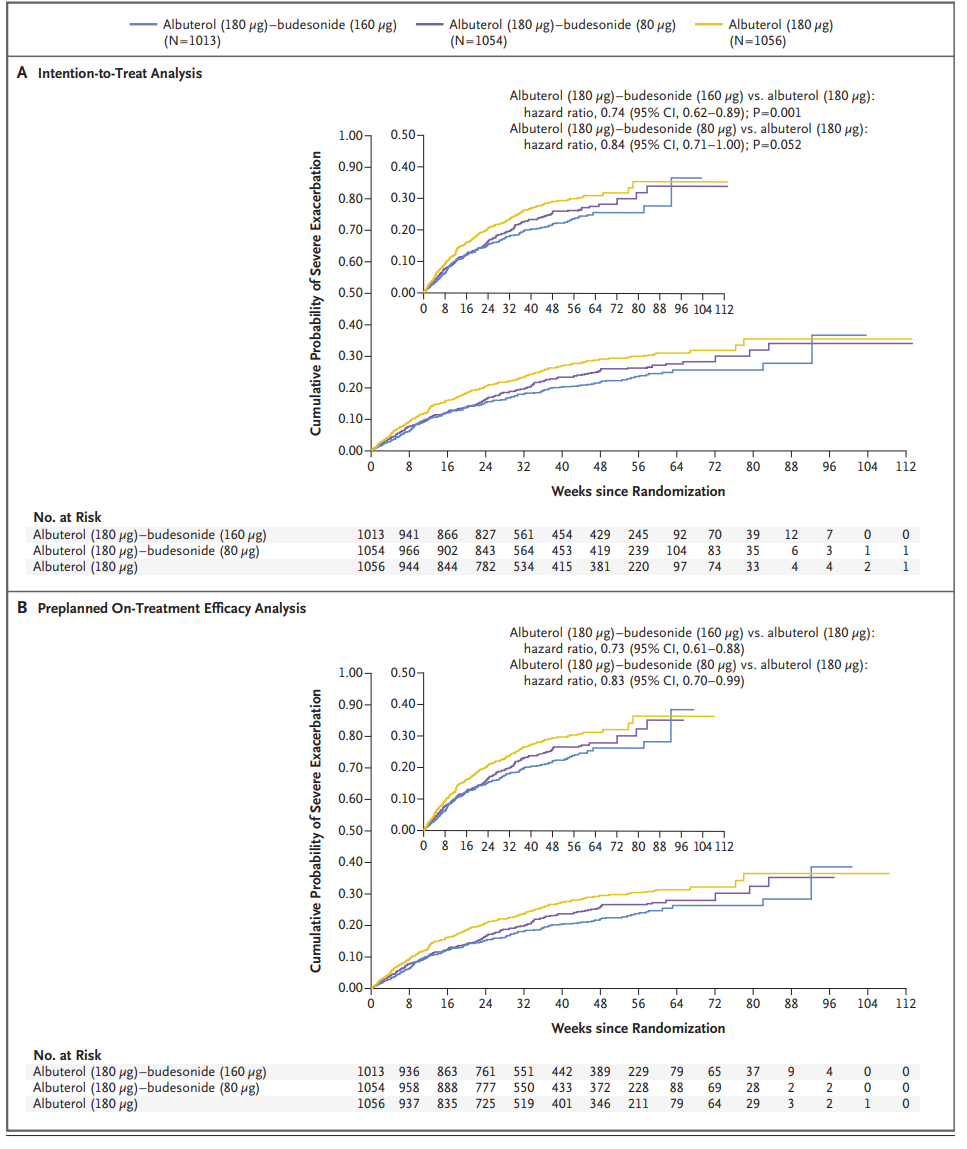
1月11日,阿斯利康宣布,美國FDA基于MANDALA和DENALI III期試驗的結果,批準Airsupra(沙丁胺醇/布地奈德,PT027)用于按需治療或預防支氣管收縮,以降低18歲及以上哮喘患者加重的風險。新聞稿指出,Airsupra是第一個也是唯一一個在美國批準用于按需治療以降低哮喘惡化風險的急救藥物。Airsupra是阿斯利康和Avillion聯合開發的一種first-in-class、壓力定量吸入器 (pMDI)固定劑量組合救援藥物,由沙丁胺醇(一種短效β2激動劑[SABA])和布地奈德(一種吸入性皮質類固醇[ICS])組成。2022年11月9日,FDA肺過敏藥物咨詢委員會(PADAC)曾以16票對1票的投票結果認為:在18歲及以上哮喘患者中,數據支持Airsupra治療哮喘的有利風險評估。而在12-17歲青少年以及4-11歲的兒童患者中,委員會投票結果均認為數據不支持Airsupra的利益風險評估。哮喘是一種慢性炎癥性呼吸道疾病,癥狀多樣,影響全球多達2.62億人。其中,美國有超過2500萬哮喘患者。MANDALA III期試驗的結果表明,相對于沙丁胺醇,Airsupra在中度至重度哮喘患者中顯著降低嚴重惡化的風險。在意向治療的事件發生時間分析中,180mcg 沙丁胺醇/160mcg 布地奈德高劑量聯合組的嚴重哮喘發作風險顯著降低26%,嚴重惡化的風險降低了27% (p<0.001),相關結果已經發表在《新英格蘭醫學雜志》。DENALI是一項評估Airsupra相較于其成分沙丁胺醇和布地奈德在成人、青少年和兒童肺功能方面的有效性和安全性 III 期臨床研究,結果顯示,Airsupra在12 歲或以上的輕度至中度哮喘患者中,相對于單獨成分沙丁胺醇和布地奈德以及安慰劑,在通過一秒鐘用力呼氣容積(FEV1)測量的肺功能改善方面具有統計學意義。美國過敏、哮喘和免疫學學院(ACAAI)前任院長、美國薩克拉門托首都過敏和呼吸疾病中心醫學主任Bradley E.Chipps說:“無論疾病嚴重程度或控制水平,哮喘患者有嚴重惡化的風險。目前的沙丁胺醇急救吸入藥物可緩解急性癥狀,但不能治療哮喘的潛在炎癥。Airsupra的獲批意味著美國的成年哮喘患者首次獲得了一種既能控制癥狀又能控制疾病炎癥性質的搶救治療。”
阿斯利康生物制藥研發執行副總裁 Mene Pangalos 表示:”在美國,每年有超過1000萬例哮喘發作患者,不受控制的哮喘病預計在未來20年給美國經濟帶來數十億美元的直接醫療費用。今天的積極決定對于占美國哮喘患者80%以上的成年哮喘患者來說是個好消息。醫生將能夠為他們的患者提供Airsupra,這是一種重要的新型救援療法,可降低哮喘惡化的風險。”
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容