3月13日,基石藥業宣布,其合作伙伴Blueprint Medicines公司近日在2023年美國過敏、哮喘和免疫學會(AAAAI)年會上公布了泰吉華(阿伐替尼片)治療惰性系統性肥大細胞增多癥(ISM)患者的PIONEER研究詳細數據。結果顯示,阿伐替尼在總癥狀評分方面取得了統計學顯著性與有臨床意義的改善,并隨著時間的推移而加深,所有類型的癥狀均有改善。此外,阿伐替尼在肥大細胞增多癥生活質量問卷(MC QoL)顯示出具有統計學顯著性與臨床意義的改善。

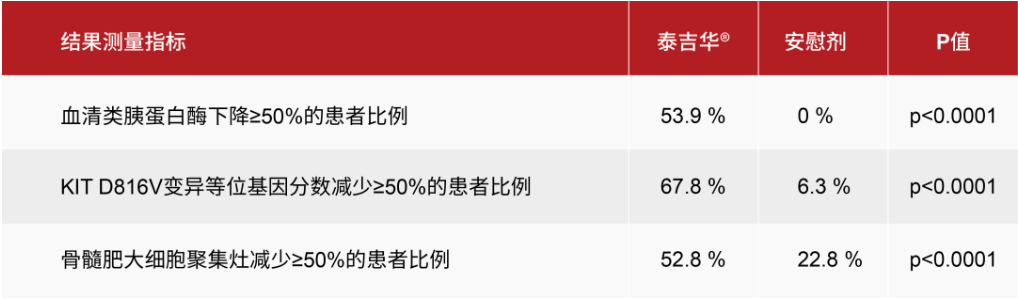
系統性肥大細胞增多癥(SM)是一種罕見的疾病,大約95%的患者是由KIT D816V突變引起的。肥大細胞失控性的增殖和激活導致多器官系統出現各種慢性、嚴重和突發癥狀。大多數患者為患有非晚期(即惰性與冒煙型)SM,其中絕大多數患者患有惰性系統性肥大細胞增多癥(ISM)。目前,全球范圍內尚無批準的治療非晚期SM的療法。阿伐替尼是一款強效、高選擇性、口服針對KIT和PDGFRA突變的激酶抑制劑,基石藥業與Blueprint Medicines公司達成獨家合作和授權協議,獲得了其在大中華地區(包括中國大陸、香港、澳門和臺灣地區)的獨家開發和商業化權利。此前,中國國家藥品監督管理局(NMPA)已批準阿伐替尼以商品名泰吉華上市銷售,用于治療攜帶PDGFRA外顯子18突變(包括PDGFRA D842V突變)的不可切除性或轉移性胃腸道間質瘤(GIST)成人患者。根據基石藥業新聞稿,PIONEER是一項隨機、雙盲、安慰劑對照、注冊研究,旨在評估阿伐替尼治療惰性系統性肥大細胞增多癥患者的療效與安全性。該研究包括三個階段:第1部分為劑量發現研究,第2部分為注冊性研究,第3部分為開放標簽擴展研究。該研究的關鍵研究終點包括通過ISM癥狀評估表(ISM-SAF)總癥狀評分(TSS)評估的患者報告的疾病癥狀變化、患者報告的生活質量、肥大細胞負荷的測量和安全性。完成第1部分或第2部分的患者有資格參加第3部分研究。所有患者在第3部分接受阿伐替尼治療,包括從安慰劑組交叉的患者。此次PIONEER研究更新結果與此前報道的一致,阿伐替尼在主要和所有關鍵次要終點均具有統計學顯著性與臨床意義的重大改善。更新的結果進一步證實了阿伐替尼在病理性肥大細胞負荷、疾病癥狀——包括總癥狀評分、最嚴重的癥狀和所有類型癥狀,以及生活質量方面均具有獲益。阿伐替尼治療的患者在各個臨床指標上均可見48周內的改善持續加深。此外,阿伐替尼耐受性良好,安全性優于安慰劑組,阿伐替尼治療的患者中96%選擇在開放標簽擴展研究中繼續接受該治療。
- 在24周時,與安慰劑相比,阿伐替尼在所有病理性肥大細胞負荷指標上均實現了快速、持久和統計學顯著的降低。
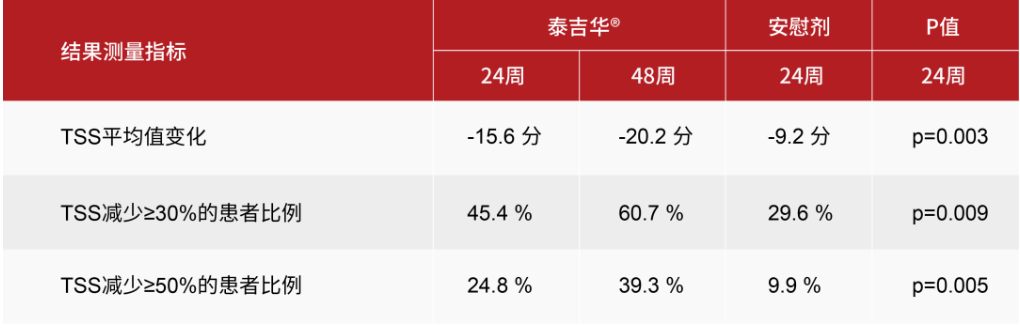
- 在24周時,與安慰劑相比,阿伐替尼在TSS方面取得了統計學上顯著且臨床上有意義的改善,在ISM-SAF所測量的所有類型的癥狀中都有改善,且隨著時間的推移而加深。
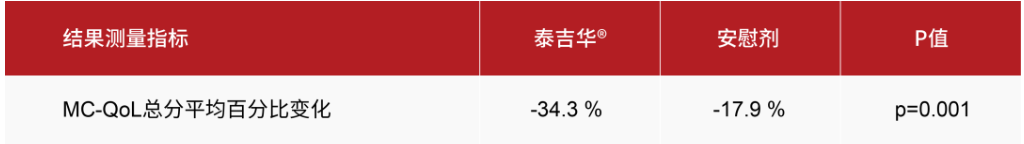
- 在24周時,與安慰劑相比,阿伐替尼在肥大細胞增多癥生活質量問卷(MC QoL)總分的平均百分比變化方面具有統計學顯著性與臨床意義的改善。
與安慰劑相比,阿伐替尼具有良好的耐受性和安全性,支持ISM長期治療的臨床需求。具體如下:
- 在所有治療組中,大多數不良事件(AEs)均為輕度至中度,導致停藥的治療相關AEs在兩組中均較低(分別為1.4%)。
- 與阿伐替尼組(5.0%)相比,安慰劑組報告的嚴重不良事件更高(11.3%)。
- 最常見的治療相關不良事件(≥5%)是頭痛、惡心、外周水腫、眶周水腫和頭暈。大多數水腫AEs為1級,沒有導致治療中止的情況。
基于PIONEER研究數據,Blueprint Medicines已經向美國FDA提交了阿伐替尼的補充新藥申請(sNDA),并向歐洲藥品管理局(EMA)提交了阿伐替尼的2型上市許可申請變更(MAA),用于治療惰性系統性肥大細胞增多癥(ISM)患者。FDA已經授予阿伐替尼該項申請的優先審評資格,PDUFA日期為2023年5月22日,同時,EMA已經確認了阿伐替尼的MAA。
[1]基石藥業宣布泰吉華(阿伐替尼片)治療惰性系統性肥大細胞增多癥的積極研究數據在美國過敏、哮喘和免疫學會(AAAAI)年會上公布. Retrieved Mar 13 , 2023. From https://mp.weixin.qq.com/s/8yn_l8wEcZ1ruXRbbLzy6g
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容