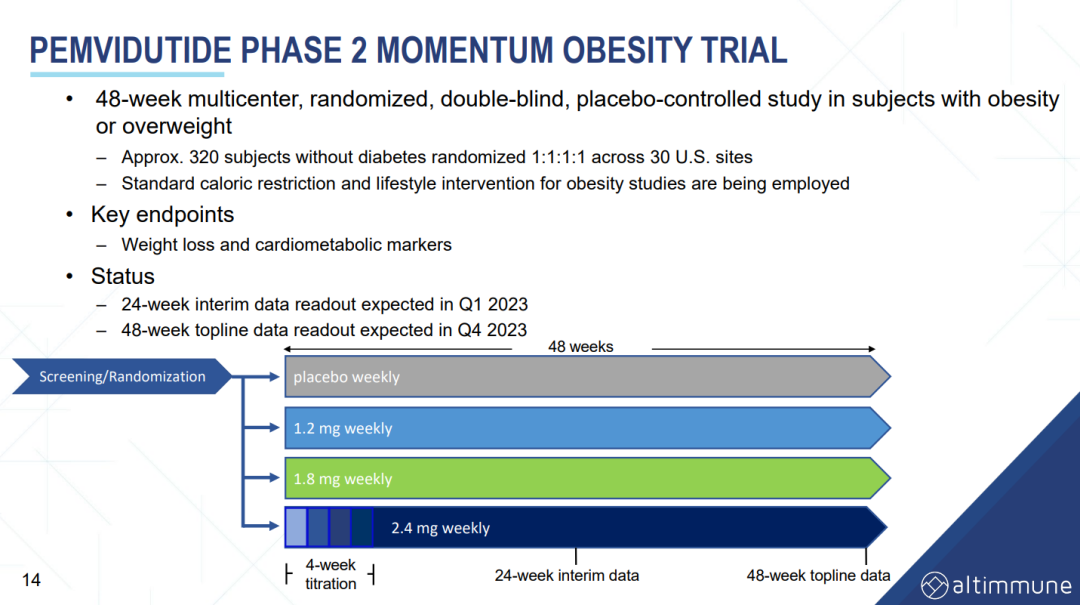
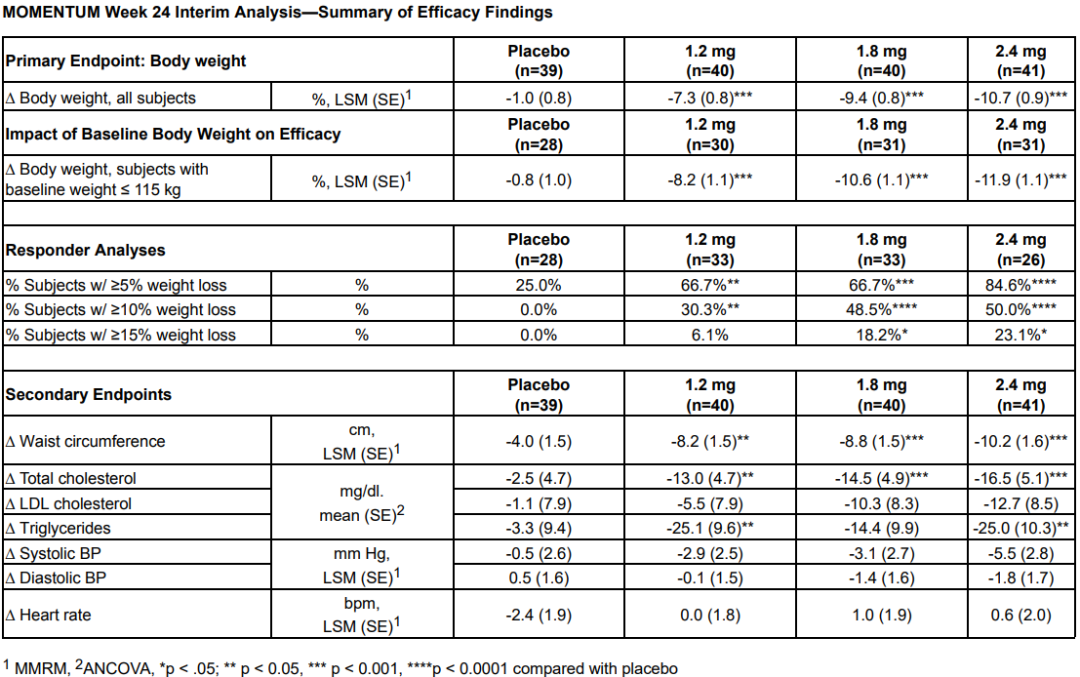
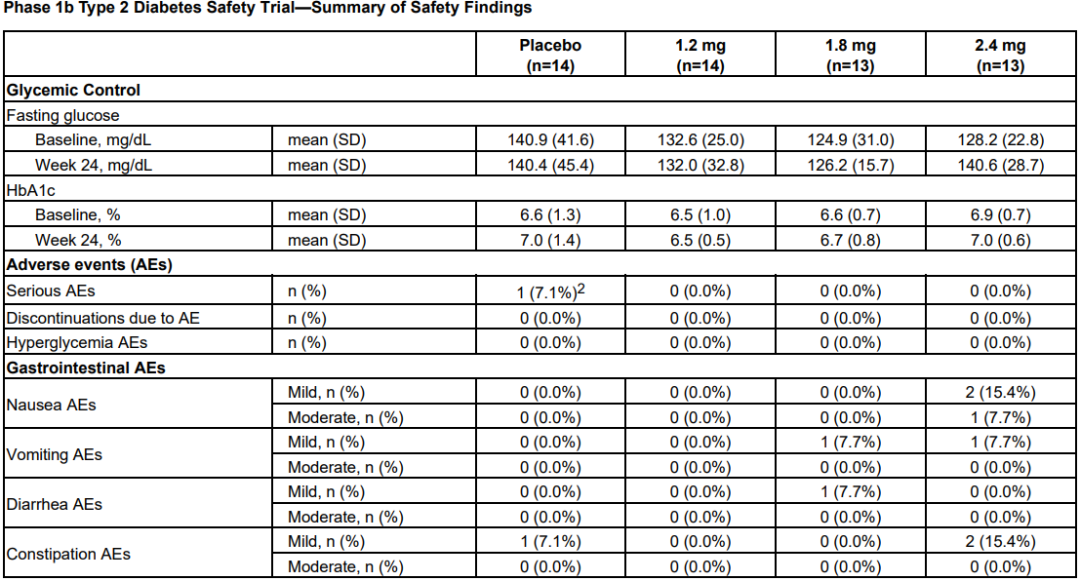
3月21日,Altimmune宣布了GLP-1R/胰高血糖素受體雙激動劑pemvidutide用于治療肥胖的為期48周II期MOMENTUM研究的第24周中期分析結果,以及用于治療肥胖或超重合并2型糖尿病的為期12周的Ib期安全性試驗結果。II期MOMENTUM研究旨在招募約320名患有肥胖或超重,至少有一種共病且無糖尿病的受試者。受試者被隨機分配,分別接受pemvidutide 1.2mg、1.8mg、2.4mg或安慰劑治療,每周用藥1次,共48周,同時輔以飲食和運動。在160名受試者完成24周的治療后,進行了預先指定的中期分析。在第24周,接受pemvidutide治療的受試者在1.2mg、1.8mg和2.4mg劑量組分別實現了7.3%、9.4%和10.7%的平均體重減輕,而安慰劑組平均體重減輕了1.0%(三種劑量組與安慰劑相比p<0.001)。基線體重≤115公斤受試者(75%的研究人群)在1.2mg、1.8mg、2.4mg和安慰劑組分別實現8.2%、10.6%、11.9%和0.8%的平均體重減輕。接受pemvidutide 1.8mg和2.4mg劑量治療的第24周,約50%的受試者體重減輕了10%或更多,約20%的受試者體重減輕了15%或更多。受試者腰圍(內臟脂肪的一種測量方法)和血脂也有明顯的下降,在沒有顯著增加心率的情況下實現了臨床意義上的血壓降低。受試者血糖維持穩態,空腹血糖或糖化血紅蛋白無明顯變化。安全性方面,上消化道(GI)事件惡心和嘔吐占不良事件的大多數。嚴重程度為輕度和中度,與劑量相關,頻率與先前試驗中觀察到相似。下消化道不良反應腹瀉和便秘在內的發生率明顯較低。一名受試者(2.4%)在2.4mg劑量下出現嚴重的惡心和嘔吐不良反應,需要補液。安慰劑組停藥率為28.2%,pemvidutide組停藥率為24.0%。Ib期試驗旨在評估pemvidutide在超重或肥胖和2型糖尿病患者中的安全性,共納入了54名受試者,按1:1:1:1隨機分組,每周給予pemvidutide 1.2mg、1.8mg、2.4mg或安慰劑,持續12周,無熱量限制或生活方式干預。受試者年齡要求為18-65歲,BMI≥28 kg/m2, 2型糖尿病,飲食和運動穩定,服用二甲雙胍,無或有輕度GI癥狀,或接受SGLT-2治療至少3個月。在為期12周的治療中,接受pemvidutide 1.2mg、1.8mg和2.4mg治療的受試者分別實現了4.4%、6.1%和7.7%的平均體重減輕,安慰劑組平均體重增加0.8%。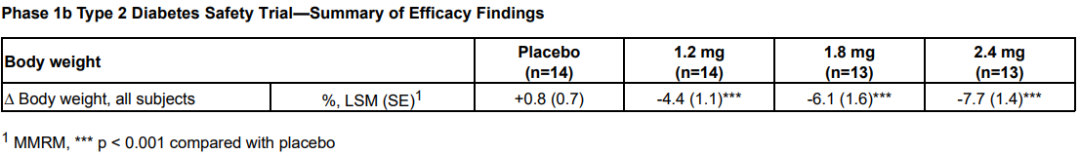
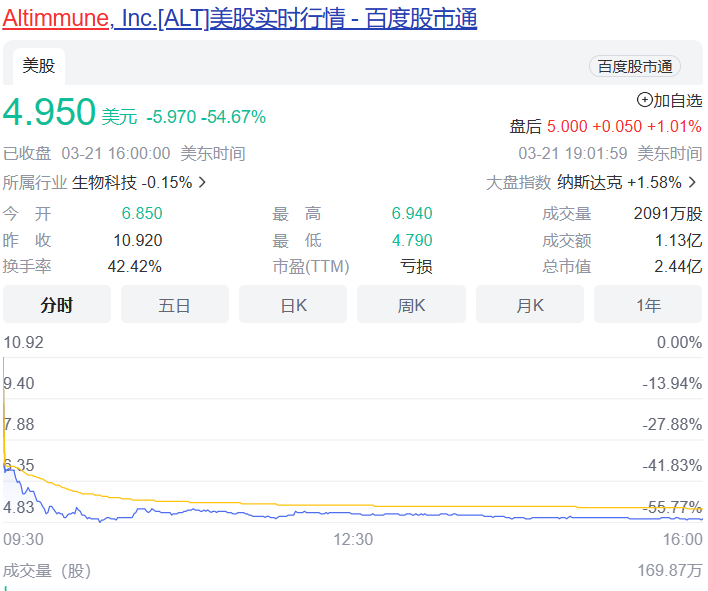
受試者在整個12周的治療期間葡萄糖維持穩態,空腹血糖或糖化血紅蛋白無明顯變化,無高血糖不良事件發生。pemvidutide組患者中未觀察到任何SAE。胃腸道不良事件發生率較低,沒有導致研究中止的不良事件。Pemvidutide(每周1次)1.2mg、1.8mg和2.4mg劑量組雖然在24周分別實現了7.3%、9.4%和10.7%的平均體重減輕,顯示出優于安慰劑的效果。不過,與安進每月僅需用藥1次,第85天(約12周),低劑量組體重平均減少7.19%,高劑量組平均減重14.52%的first-in-class抗體多肽偶聯藥物AMG 133相比略顯遜色。再加上市場上已有禮來Tirzepatide和諾和諾德司美格魯肽的競爭,Pemvidutide的表現顯然沒有讓投資人滿意,導致該公司股價在消息公布后大跌54%。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容