
2024-05-25 00:00:00來源:陶術生物瀏覽量:237

?
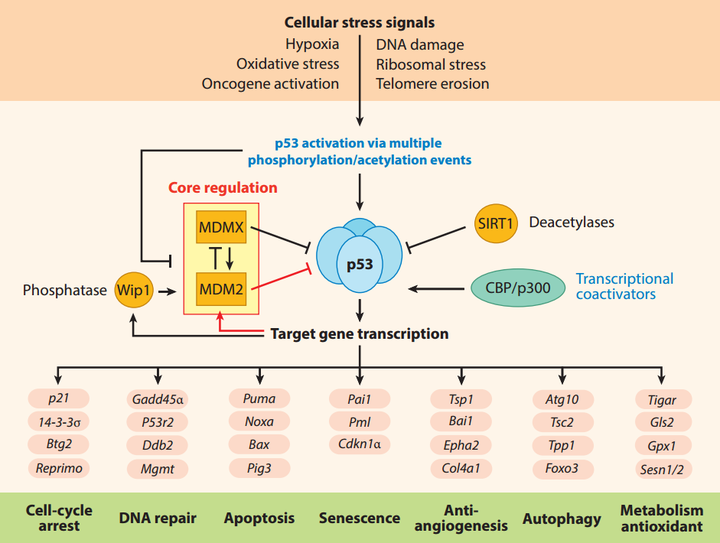
轉錄因子P53在細胞周期中發揮著核心作用,并且可以說是最重要的腫瘤抑制因子之一。在細胞受到DNA損傷或致癌壓力等信號時,P53通過一系列磷酸化事件和其它后轉錄修飾(PTM)被激活,導致P53靶基因的表達,這些基因參與細胞周期停滯、DNA修復,或者如果無法修復,則會引發細胞凋亡。
?
 ?
?
▲p53通過多種磷酸化事件在細胞應激下被激活
P53研究歷史
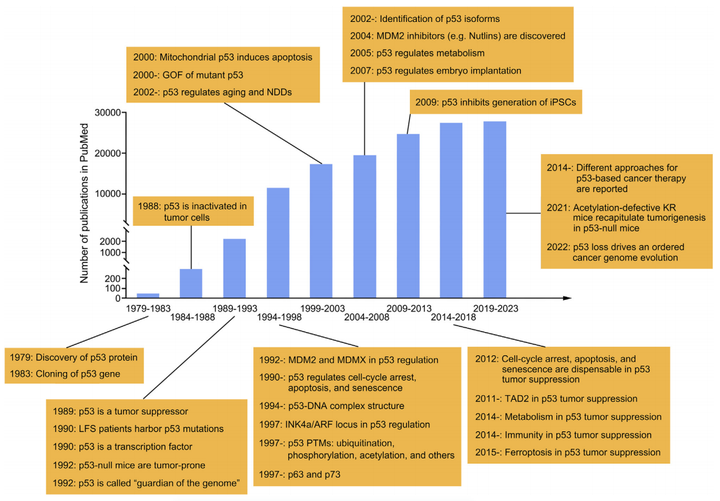
p53的研究歷程可以追溯到1979年,當時p53蛋白被多個研究團隊獨立發現,這些研究團隊在關于猴病毒40(SV40)的研究中發現了p53蛋白。最初人們認為p53是參與細胞轉化的癌基因,但在1989年,一系列論文揭示了野生型(WT)p53實際上是一種腫瘤抑制基因。
?
 ?
?
▲P53研究歷史
?
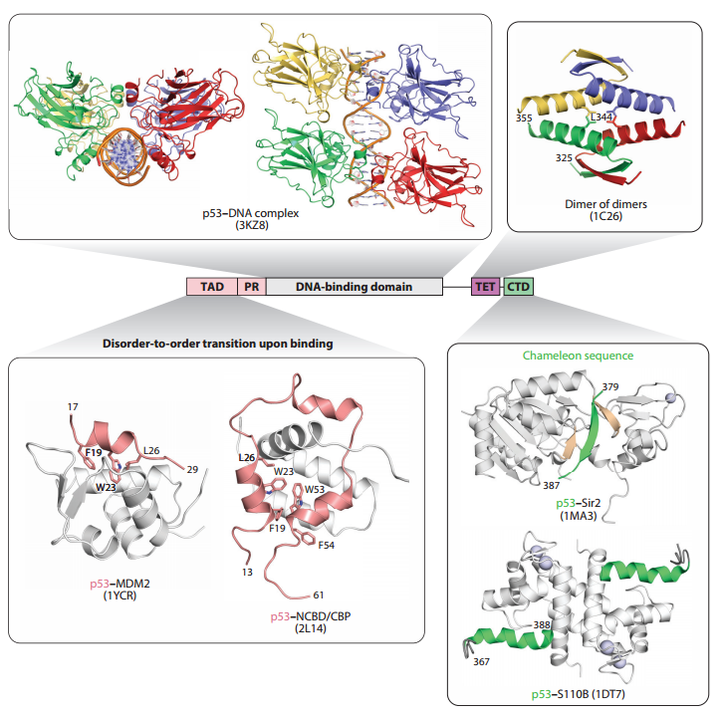
人類P53基因家族包括三個成員:P53、P63、P73。P53蛋白主要作為轉錄因子(TF)發揮作用,人類中的全長p53蛋白(FLp53)包括393個氨基酸,分為五個不同的結構域:N-末端轉錄活化結構域(TAD)、富含脯氨酸結構域(PRD)、中央DNA結合結構域(DBD)、四聚體化結構域(TD)和C-末端調節結構域(CTD)。
在未受到壓力的細胞中,p53蛋白呈現單體、二聚體和四聚體狀態的混合,其中二聚體占主導地位。在各種類型的應激信號(包括DNA損傷、致癌基因激活、核糖體應激、端粒侵蝕、營養匱乏和缺氧)作用下,大多數p53蛋白通過其TD迅速組裝成功能四聚體(二聚體的二聚體)。通過使用DBD,這種四聚體識別位于靶基因的啟動子或增強子上的p53結合位點以調節轉錄。
?
此外,p53的轉錄活化結構域(TAD)和調節結構域(CTD)本質上是無序的,這有助于它們與轉錄介質的相互作用。這兩個結構域也是主要經歷翻譯后修飾(PTMs)的區域。
?
 ?
?
▲P53結構
P53的調控
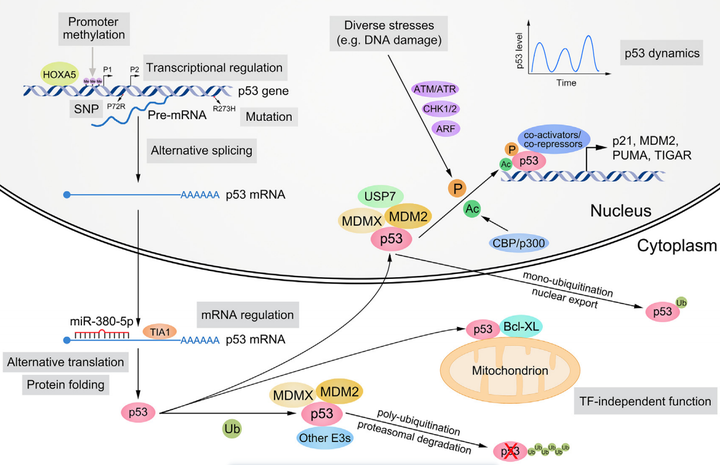
p53的表達和活性受到DNA、RNA和蛋白質水平上多層次的調控。
?
在DNA水平上,p53基因可能發生SNP和突變。p53具有兩個啟動子,可以被甲基化并沉默。p53基因的轉錄受到各種轉錄因子(例如,HOXA5)的激活或抑制。
在RNA水平上,p53 mRNA的細胞定位、穩定性和翻譯由RNA結合蛋白(如TIA1)和非編碼RNA(如miR-380-5p)調節。p53前體mRNA和mRNA可以分別進行替代剪接和替代翻譯。
?
在蛋白質水平上,p53的折疊、穩定性、細胞定位、DNA結合、轉錄激活能力和靶向選擇主要由翻譯后修飾(例如,泛素化、磷酸化和乙酰化)和輔因子(例如,MDM2、MDMX和CBP)介導。各種壓力信號(如DNA損傷)可以激活p53,其作為轉錄因子的活性具有高度的動態性。p53在細胞質中還表現出TF獨立功能(例如,通過與Bcl-XL相互作用促進凋亡)。
?
 ?
?
▲P53的調控
P53的功能
p53表現出多樣且復雜的功能——
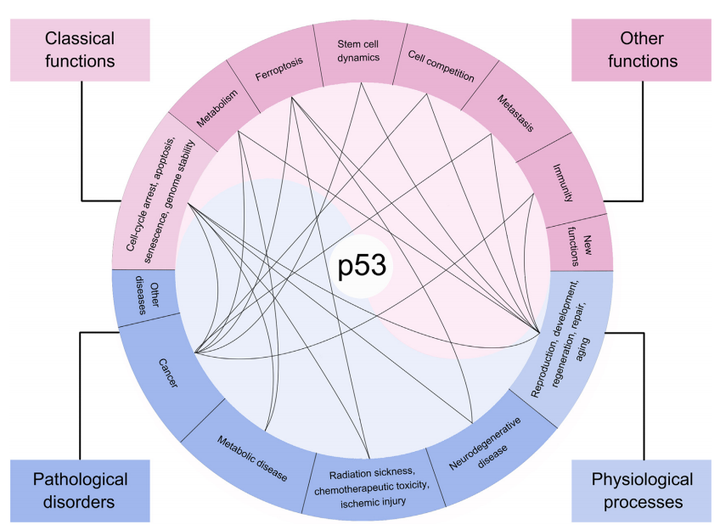
經典功能:包括誘導細胞周期阻滯、凋亡和衰老,以及維持基因組穩定性等。
其他功能:如介導新陳代謝、鐵死亡、干細胞動態、細胞競爭、轉移和免疫等。
?
由于其廣泛的功能,p53在許多生理過程(如生殖、發育、再生、修復和衰老)和病理疾病(如神經退行性疾病、輻射中毒、化療毒性、缺血損傷、代謝性疾病和癌癥)中起著關鍵作用。
?
 ?
?
▲P53的功能以及其在病理中的作用
?
舉個例子:細胞周期阻滯、細胞凋亡、衰老和基因組穩定性
p53的細胞周期阻滯、凋亡和衰老誘導是最早發現的功能之一。各種壓力信號都可以誘導p53發揮這些功能,其中DNA損傷是最強的”觸發器“。
?
在DNA損傷時,p53被穩定并激活以阻止細胞周期,為細胞提供了一個時間窗口和足夠的物質和能量,以修復受損的DNA。如果損傷過于嚴重無法修復,p53將通過誘導凋亡和衰老來消除受損細胞。值得注意的是,p53激活的結果也取決于細胞類型和DNA損傷類型。這三種活動被廣泛接受為防止腫瘤發生的主要障礙。另一方面,未能消除受損細胞會導致基因組不穩定性。p53的喪失,包括等位基因喪失(LOH)和雙等位基因失活或缺失,促進了基因組不穩定性,并推動了腫瘤細胞基因組的演化。
?
然而,目前尚不清楚p53介導的這些與DNA修復相關的靶點的激活是否足以獨立于其他p53活動來抑制腫瘤發生。
再舉個例子:代謝和鐵死亡
p53在調節葡萄糖、脂質、氨基酸、核苷酸、鐵以及氧化還原過程等多種代謝方面起著主導作用。它還調節自噬,并與AMPK、AKT和mTOR等主要代謝調節因子有廣泛的交互作用。這使得p53與幾種代謝性疾病,尤其是癌癥有關。
?
一般來說,p53抑制合成代謝過程(例如新生脂肪生成和核苷酸合成),同時促進分解代謝過程(包括氧化磷酸化、脂解和脂肪酸氧化)。增強的糖酵解在癌細胞中產生多種分子物質用于生物合成,因此也被p53抑制。這些p53的活動抵消了癌細胞快速增殖的需求,從而導致腫瘤抑制。
?
鐵死亡是一種鐵依賴性的調控性細胞死亡形式,在脂質過氧化物過量的情況下發生,與代謝途徑密切相關。P53的一些代謝靶點直接參與調節鐵死亡,如SLC7A11、VKORC1L1、GLS2和PLTP。P53介導的鐵死亡也被認為是腫瘤抑制的重要武器。
靶向P53治療癌癥
目前已經開發出了多種方法來針對p53進行癌癥治療。在保留WT p53的腫瘤中,RG7388、APG-115和ALRN-6924被用來干擾p53與MDM2或MDMX之間的蛋白相互作用,而RITA、tenovin-6、ML364和UNC0379則針對p53的其他負調控因子。
?
在含有p53錯義突變的腫瘤中,APR-246、COTI-2?和PAT等能夠恢復許多p53突變體的WT構象。特定的藥物如PhiKan083、PK7088和MS78則針對p53 Y220C突變,而ZMC1用于p53 R175H突變。
?
此外,基因組編輯可能有助于糾正p53基因突變。NSC59984、ganetespib、MCB-613和納米受體能夠降解突變p53。像ReACp53和ADH-6這樣的藥物則能解決突變p53的聚集,部分恢復WT p53功能。識別突變p53衍生的新抗原的抗體如P1C1TM和H2-scDb,通過免疫細胞介導腫瘤細胞消除。p53MVA和p53-SLP則是免疫治療中使用的p53疫苗。突變p53新抗原也可用于開發細胞免疫治療。突變p53 DNA片段和蛋白(包括其聚集體)可用于腫瘤診斷和預后。
?
在存在 p53 無義突變的腫瘤中,G418、2,6-DAP、CC-90009和NMDI14,可以誘導 p53 突變型 mRNA 的誘導翻譯通讀(readthrough),或抑制 NMD。在p53-null腫瘤中,提供p53蛋白、mRNA和DNA可以恢復p53表達并消滅腫瘤細胞。
?
總之,P53 蛋白是一種轉錄因子和腫瘤抑制蛋白,可結合 DNA 并調控多種轉錄靶標,響應細胞應激或 DNA 損傷,協調細胞周期阻滯、DNA 修復、代謝改變、凋亡等過程,防止腫瘤形成。陶術可提供多種激動劑、抑制劑助力P53相關研究,歡迎私信咨詢~
?
 ?
?
?
參考文獻:
Liu et al., Understanding the complexity of p53 in a new era of tumor suppression, Cancer Cell (2024).
Lane, D. P. (1992). Cancer. p53, guardian of the genome. Nature, 358(6381), 15-16.
Levine, A. J., & Oren, M. (2009). The first 30 years of p53: growing ever more complex. Nature Reviews Cancer, 9(10), 749-758.
Vousden, K. H., & Prives, C. (2009). Blinded by the Light: The Growing Complexity of p53. Cell, 137(3), 413-431.
Joerger, A. C., & Fersht, A. R. (2016). The p53 pathway: origins, inactivation in cancer, and emerging therapeutic approaches. Annual Review of Biochemistry, 85, 375-404.
Muller, P. A., & Vousden, K. H. (2013). p53 mutations in cancer. Nature Cell Biology, 15(1), 2-8.
Vogelstein, B., Lane, D., & Levine, A. J. (2000). Surfing the p53 network. Nature, 408(6810), 307-310.
?