
2024-06-27 11:21:19來源:醫藥觀瀾瀏覽量:3295
▎藥明康德內容團隊編輯
根據中國國家藥監局(NMPA)官網批件信息及公開資料統計,截至6月26日,2024年上半年共有43款新藥*首次在中國獲批上市,其中1類創新藥有21款;另外還有約40款新藥在中國獲批一項或多項新適應癥/新劑型。(*本文中“新藥”的統計范圍包括:化學藥品1類和5.1類、治療用生物制品1類和3.1類,不含疫苗類產品)
梳理上半年在中國獲批上市的新藥,我們發現以下特點:
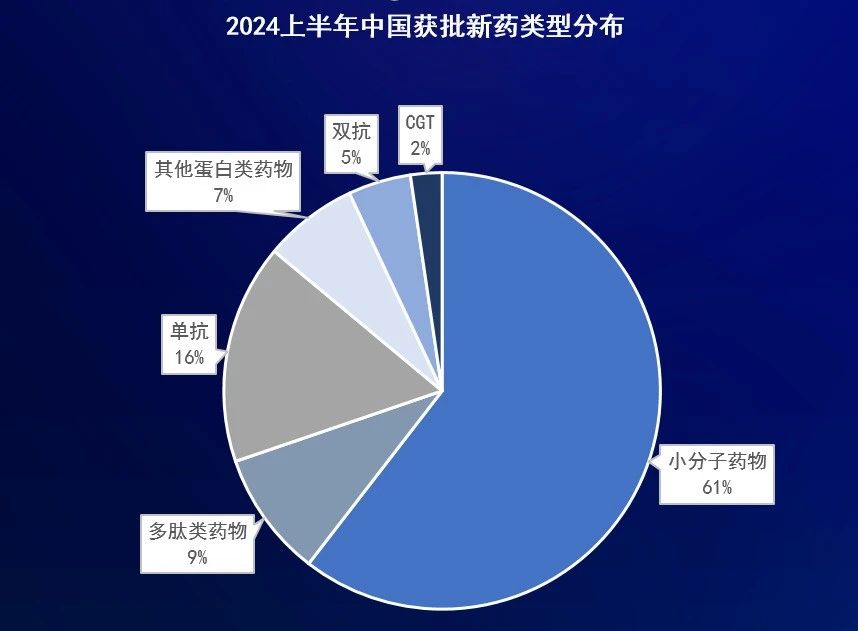
首次獲NMPA批準上市的新藥中,1類創新藥有21款,占比約為50%。這些新藥中有4款來自國際藥企,包括衛材/渤健、諾華、羅氏、諾和諾德;其余十多款來自恒瑞醫藥、海思科、正大天晴、康方生物、科濟藥業等中國公司,其中正大天晴有3款1類新藥迎來獲批上市,海思科、再鼎醫藥均有2款新藥獲批上市。
從適應癥來看,首次獲NMPA批準上市的新藥中,抗腫瘤適應癥最多,占比約為35%;其次是代謝類疾病和罕見病,占比均為16%左右。其中代謝類疾病中有6款新藥均針對2型糖尿病。

從藥物類型來看,首次獲NMPA批準上市的新藥中,小分子新藥占比最多,達到60%,這些新藥的靶點涵蓋SGLT-2、CGRP、ROS1、EGFR、ALK、DPP4等;其次是單克隆抗體藥物,占比為16%,包括了皮下注射的抗HER2單抗復方制劑、每月一次的CGRP單抗、長效抗RSV單抗、抗Aβ單抗、每四周一次的抗C5單抗等等。
除了首次獲批上市的新藥,還有約40款新藥在中國獲批了44項新適應癥/新劑型,其中抗PD-1/L1單抗獲批了10項新適應癥,數量最多,JAK抑制劑、酪氨酸激酶抑制劑、GLP-1受體激動劑等新適應癥的獲批也備受關注。
多款境外新藥或新適應癥在中國實現了全球首次獲批,意味著這些新藥正在以更快的速度惠及中國患者。比如:羅氏的新型抗C5循環單克隆抗體可伐利單抗在中國實現全球首批、勃林格殷格翰的罕見皮膚病創新藥佩索利單抗(皮下注射)在中國實現全球首發、艾爾建美學A型肉毒毒素針對咬肌突出的新適應癥在中國實現全球首批……
以下將介紹上半年首次獲NMPA批準上市的1類新藥。(掃描文末二維碼,您將可以獲取由我們整理的《2024上半年中國獲批上市新藥》完整名單)。
衛材/渤健:侖卡奈單抗
1月9日消息,衛材(Eisai)/渤健(Biogen)侖卡奈單抗注射液正式在中國獲批上市,用于治療早期阿爾茨海默病。根據衛材新聞稿介紹,侖卡奈單抗是一款人源化抗可溶性β淀粉樣蛋白(Aβ)單抗,它可清除大腦中的Aβ原纖維和Aβ斑塊,延緩阿爾茨海默病疾病進展、降低認知和功能衰退速度。
惠升生物:脯氨酸加格列凈片
1月19日消息,四環醫藥旗下惠升生物研發的SGLT-2抑制劑加格列凈片在中國獲批上市,用于治療2型糖尿病。該產品是一類非胰島素依賴性的降血糖藥物,通過作用于體內的SGLT-2轉運蛋白,防止已濾過的葡萄糖在腎臟內重吸收,從而有效控制血糖水平。
恒瑞醫藥:富馬酸泰吉利定
1月31日消息,NMPA宣布批準恒瑞醫藥富馬酸泰吉利定注射液上市,適用于腹部手術后中重度疼痛。這是一款靶向μ阿片受體(MOR)的小分子藥物。MOR激動劑是阿片類藥物中鎮痛作用較強的一類。據恒瑞醫藥公開資料介紹,與經典的MOR激動劑相比,泰吉利定可在產生類似的中樞鎮痛作用的同時,降低常見的胃腸道不良反應發生率。
羅氏:可伐利單抗注射液
2月7日,NMPA宣布批準羅氏(Roche)可伐利單抗注射液上市,用于未接受過補體抑制劑治療的陣發性睡眠性血紅蛋白尿癥成人和青少年(≥12歲)患者。可伐利單抗是一款新型抗C5循環單克隆抗體,患者可每四周一次在家中自行皮下注射。值得一提的是,該品種為全球同步研發,中國首先批準上市。而根據羅氏新聞稿,這也是該公司第一次在中國市場實現一款創新物的全球首發。
科濟藥業:澤沃基奧侖賽注射液
3月1日消息,科濟藥業靶向BCMA的CAR-T細胞產品澤沃基奧侖賽注射液在中國獲批上市,用于治療復發或難治性多發性骨髓瘤成人患者。該藥獲批上市是基于一項在中國進行的單臂1/2期臨床試驗。研究有效性數據顯示,102例患者的中位隨訪時間為9個月,總緩解率(ORR)為92.2%,非常好的部分緩解(VGPR)及以上緩解的比率為85.3%,完全緩解/嚴格意義完全緩解率(CR/sCR)的比率為45.1%。
科州制藥:妥拉美替尼
3月15日,NMPA宣布通過優先審評審批程序附條件批準科州制藥妥拉美替尼膠囊上市,適用于含抗PD-1/PD-L1治療失敗的NRAS突變的晚期黑色素瘤患者。這是一款針對NRAS突變的ATP非競爭性MEK抑制劑。在關鍵2期注冊研究中,有效性分析集中經確認的ORR為34.7%,中位無進展生存期(mPFS)為4.2個月,1年總生存期(OS)率為57.2%,既往接受過免疫治療的ORR達到39.1%。
諾華:鹽酸伊普可泮膠囊
4月26日,諾華(Novartis)宣布鹽酸伊普可泮膠囊在中國獲批上市,用于治療既往未接受過補體抑制劑治療的陣發性睡眠性血紅蛋白尿癥(PNH)成人患者。這是一款特異性補體B因子口服抑制劑,為PNH提供了一種新型的口服單藥靶向治療選擇。在關鍵3期研究中,在接受治療24周后,大多數患者的血紅蛋白水平達到12g/dL或以上,幾乎所有患者實現避免輸血,患者報告的疲勞也有所改善。
正大天晴:安奈克替尼
4月30日消息,正大天晴宣布其自主研發的創新藥富馬酸安奈克替尼膠囊在中國獲批上市,用于ROS1陽性的局部晚期或轉移性非小細胞肺癌成人患者。安奈克替尼是新型小分子受體酪氨酸激酶抑制劑,對ALK、ROS1和MET基因突變均有較強的抑制作用。在一項2期研究中,111例受試患者基于IRC(獨立評審委員會)評估的ORR達到81.08%,緩解持續時間(DOR)中位數達到20.3個月。
億騰景昂:恩替司他片
4月30日,億騰景昂宣布恩替司他片在中國獲批上市,用于聯合芳香化酶抑制劑治療HR+/HER2-經內分泌治療復發或進展的局部晚期或轉移性乳腺癌患者。恩替司他是一種新型、口服的HDAC抑制劑,該藥憑借半衰期較長的獨特特性,實現了一周一次的臨床給藥方式。
正大天晴:貝莫蘇拜單抗
5月9日,正大天晴宣布貝莫蘇拜單抗已在中國獲批上市,聯合安羅替尼膠囊和依托泊苷及卡鉑一線治療廣泛期小細胞肺癌(ES-SCLC)。這是一款全新序列的創新抗PD-L1人源化單克隆抗體,在3期ETER7011臨床研究中,接受貝莫蘇拜單抗聯合療法的患者中位OS達19.3個月,較單純化療組延長了7.4個月。
圖片來源:123RF
再鼎醫藥/百時美施貴寶:瑞普替尼膠囊
5月11日,NMPA宣布批準瑞普替尼膠囊上市申請,適用于ROS1陽性的局部晚期或轉移性非小細胞肺癌成人患者。瑞普替尼是一款ROS1和NTRK靶向抑制劑,再鼎醫藥擁有該產品在大中華區的獨家開發及商業化權。在治療ROS1陽性非小細胞肺癌成人患者的臨床研究中,針對中國亞組ROS1 TKI初治隊列患者,經BICR評估的經確認的ORR達到91%。
海思科:苯磺酸克利加巴林膠囊
5月20日,NMPA宣布批準海思科苯磺酸克利加巴林膠囊上市,用于治療成人糖尿病性周圍神經病理性疼痛(DPNP)。克利加巴林為抑制性神經遞質GABA的結構衍生物,為一款無需滴定的口服第三代中樞神經系統鈣離子通道調節劑,具有鎮痛、抗癲癇和抗焦慮的活性。相比于同機制藥物,該產品與α2δ亞受體結合力更強,預期止痛療效更好。
再鼎醫藥/Entasis公司:SUL-DUR
5月20日,NMPA宣布批準“注射用舒巴坦鈉/注射用度洛巴坦鈉組合包裝”上市申請,用于治療18歲及以上患者由鮑曼-醋酸鈣不動桿菌復合體敏感分離株所致醫院獲得性細菌性肺炎(HABP)、呼吸機相關性細菌性肺炎(VABP)。這是再鼎醫藥引進的抗感染新藥SUL-DUR,由舒巴坦(一種靜脈輸注的β-內酰胺類抗生素)和durlobactam(一種新型廣譜靜脈輸注的β-內酰胺酶抑制劑,或稱BLI)組合而成。
倍而達藥業:甲磺酸瑞齊替尼膠囊
5月20日,NMPA宣布批準倍而達藥業的甲磺酸瑞齊替尼膠囊上市,適用于治療既往經EGFR-TKI治療時或治療后出現疾病進展,并且經檢測確認存在EGFR T790M 突變陽性的局部晚期或轉移性非小細胞肺癌成人患者。瑞齊替尼是EGFR激酶抑制劑,對EGFR突變體(如EGFR T790M、L858R)具有不可逆抑制作用。
康方生物:依沃西單抗
5月24日,NMPA宣布批準康方生物依沃西單抗注射液上市,用于聯合培美曲塞和卡鉑,治療經EGFR-TKI治療后進展的EGFR基因突變陽性的局部晚期或轉移性非鱗狀非小細胞肺癌(nsq-NSCLC)患者。依沃西單抗是一種靶向VEGF-A和PD-1的IgG1亞型人源化雙特異性抗體。在3期HARMONi-A研究中,依沃西單抗聯合化療治療EGFR-TKI進展EGFR突變nsq-NSCLC相較于對照組顯著延長患者PFS(7.1個月 vs 4.8個月),降低疾病進展或死亡風險54%;OS獲益趨勢明顯(17.1個月 vs 14.5個月),降低死亡風險20%,且安全性可控。該研究已經于今年6月獲《美國醫學會雜志》(JAMA)在線發表。
興盟生物:澤美洛韋瑪佐瑞韋單抗注射液
6月12日消息,興盟生物澤美洛韋瑪佐瑞韋單抗注射液已在中國獲批上市,這是一款抗狂犬病病毒單克隆抗體組合制劑——單抗雞尾酒療法產品,由兩株靶向狂犬病毒糖蛋白不同中和位點的人源化單克隆免疫球蛋白IgG1κ抗體混合制成,主要用于成人狂犬病病毒暴露者的被動免疫。
正大天晴:枸櫞酸依奉阿克膠囊
6月17日,NMPA宣布批準正大天晴的創新藥枸櫞酸依奉阿克膠囊上市,用于未經過ALK抑制劑治療的ALK陽性的局部晚期或轉移性非小細胞肺癌患者的治療。依奉阿克膠囊是正大天晴自主研發的新一代ALK抑制劑。該產品對比第一代ALK抑制劑一線治療ALK陽性晚期非小細胞肺癌的3期臨床研究顯示,IRC評估的mPFS分別為24.87個月與11.6個月。針對基線存在可評估腦轉移病灶的患者,依奉阿克對比對照藥的ORR分別為78.95%和23.81%,DOR分別為25.82個月和7.39個月。
圣和藥業:甲磺酸瑞厄替尼片
6月17日,NMPA宣布批準圣和藥業甲磺酸瑞厄替尼片上市,用于治療既往經EGFR-TKI治療時或治療后出現疾病進展,并且經檢測確認存在EGFR T790M突變陽性的局部晚期或轉移性非小細胞肺癌成人患者。根據圣和藥業新聞稿,在2期關鍵性臨床研究中,瑞厄替尼片治療患者經IRC評估的ORR為60.8%,疾病控制率(DCR)為92.5%,中位PFS為12.2個月,中位緩解持續時間(DoR)為13.9個月,表現出良好的治療效果。
迪哲醫藥:戈利昔替尼膠囊
6月19日,迪哲醫藥宣布高選擇性JAK1抑制劑戈利昔替尼膠囊在中國獲批上市,單藥適用于既往至少接受過一線系統性治療的復發或難治的外周T細胞淋巴瘤(r/r PTCL)成人患者。該產品的關鍵性注冊臨床研究已經發表于《柳葉刀·腫瘤學》(Lancet Oncology),戈利昔替尼單藥治療r/r PTCL的ORR達到44.3%,DoR達到20.7個月。
諾和諾德:依柯胰島素注射液
6月24日,NMPA宣布已批準諾和諾德(Novo Nordisk)的依柯胰島素注射液上市,用于治療成人2型糖尿病。這是一種新型的基礎胰島素類似物,該產品經過創新的分子設計和結構修飾,作用時間顯著延長,每周一次皮下注射即可滿足一整周的基礎胰島素需求。根據諾和諾德新聞稿,依柯胰島素是該公司首次實現在中國、歐盟和美國同步開展臨床試驗,同步遞交上市申請的產品。

圖片來源:123RF
海思科:考格列汀片
6月24日,NMPA宣布批準海思科創新藥考格列汀片上市,適用于改善成人2型糖尿病患者的血糖控制。考格列汀是海思科開發的長效DPP-4抑制劑,其半衰期超過100小時,14天DPP-4酶抑制率仍能達到80%,從而可以實現雙周一次的長給藥間隔。考格列汀單藥/聯合二甲雙胍治療的多項研究顯示,無論是初診初治患者人群還是二甲雙胍控制不佳的患者人群,經過考格列汀治療24周后,糖化血紅蛋白(HbA1c)相較基線可以降低0.9%以上。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容