
2024-08-29 16:22:25來源:CDE瀏覽量:502
隨著司美格魯肽注射液(Ozempic?)以及司美格魯肽片(Rybelsus?)原研藥在我國上市,國內生物醫藥企業按照生物類似藥路徑開發的司美格魯肽生物類似藥日漸增多。本文梳理了司美格魯肽原研藥及生物類似藥國內外注冊與研發現狀,分析了司美格魯肽質量研究和質量相似性評價中的挑戰及相關技術要求,結合審評實踐對司美格魯肽生物類似藥的藥學評價中常見問題進行分析探討,以期為此類生物類似藥的藥學開發與評價提供參考。
1. 1 司美格魯肽原研產品注冊情況
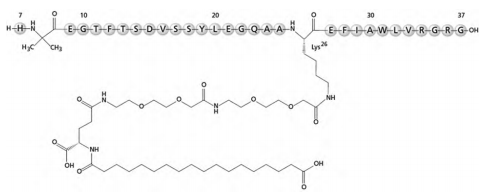
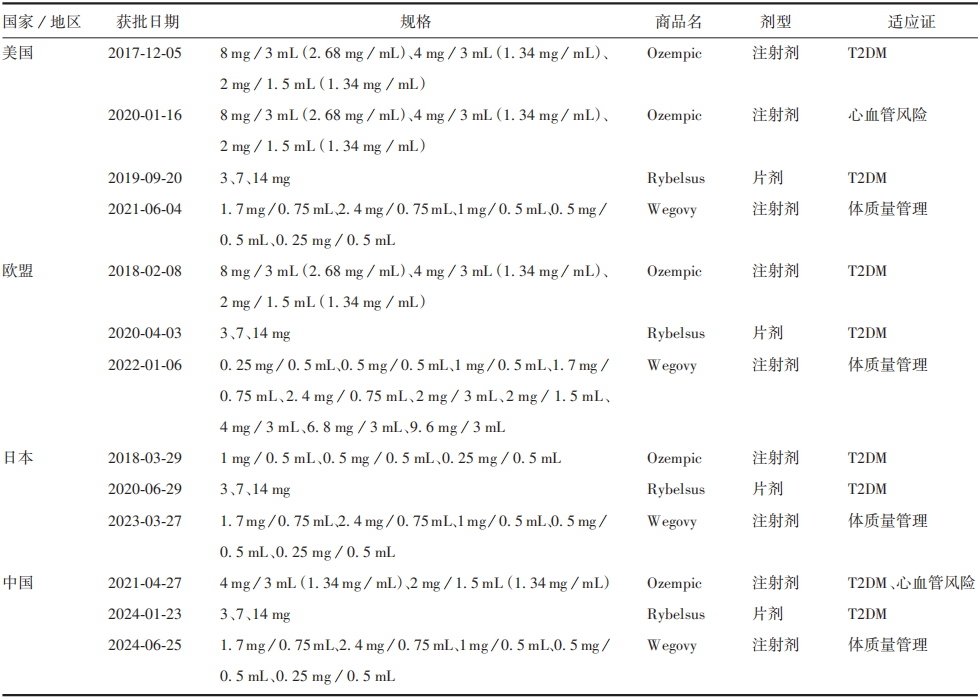
1. 2 司美格魯肽原研產品臨床研究現狀

1.3 原研產品變更情況
1. 4 國內外司美格魯肽生物類似藥研發進展
3. 1 表達系統
3. 2 脂肪酸酰化側鏈
3. 3 司美格魯肽前體[Aib8,Arg34 GLP?1(7?37)]
3. 4 口服制劑
3. 5 相似性研究
3. 6 國外生物類似藥新發布指南


微信公眾號

藥方舟手機版
