
2021-09-28 15:36:49來源:新浪醫藥新聞瀏覽量:630
導讀:2015年-2021年,中國創新藥發展現狀如何?與國際之間還存在哪些差距,預計什么時候能夠實現追趕與超越?
數據顯示,2021年上半年,我國批準創新藥21個,超過了2020年全國審評通過的創新藥數量,刷新了我國創新藥審評記錄。21個創新藥包括新冠病毒疫苗、腫瘤、免疫系統疾病、罕見病等領域的臨床急需治療藥物,其中多個為我國自主研發并擁有自主知識產權的產品。
我國創新藥快速發展繁榮背后,源自2015年之后中國藥品審評審批加速、ICH指導原則落地等一系列的綜合改革,在此之下,我國藥品監管體系逐步與國際接軌,趨于成熟。
2015年-2021年,中國創新藥發展現狀如何?與國際之間還存在哪些差距,預計什么時候能夠實現追趕與超越?在中國藥企熱火朝天進行創新轉型升級當中,同時也伴隨來了一些棘手的問題,如靶點同質化、內卷,如何快速商業化等,中國創新藥未來的路在何方,又該如何進行創新、定義創新?在2021年西普會上,結合創新藥本土和國際發展的實際情況,業界大佬們是這樣說的。
01 7年“脫胎換骨”中國創新藥水平如何?
2015年前,外部政策環境因素與市場行為不規范因素嚴重限制了中國制藥企業創新發展的積極性和動力,醫藥行業長期處于低水平仿制階段。2015年開始,國家藥品領域的一系列重大改革舉措,中國醫藥產業迅速進入了快速跟跑的創新轉型發展期。
2015年,可以說是中國醫藥創新元年。依此來算,中國創新藥真正發展的歷程,不過才短短7年。
在亞盛醫藥董事長兼CEO楊大俊看來,2015年之前,中國對于創新藥的定義為“只要國內沒有就是創新藥,享受1.1類新藥的待遇”。但是在2015年之后,這個定義發生變化,“國內外新”才能算得上是創新藥。
百濟神州總裁吳曉濱認為,2015年是中國創新藥的元年,此后中國創新藥研發速度非常之快。其中,可以看到由于創新藥快速發展,也帶來了大量的臨床試驗。2001年,全國的臨床試驗只有360個,其中一半是外企,十年以后已經發展到1700個臨床試驗在同時進行,而且1300多個都是本土創新企業在做,質量上已經發生了巨大轉變。
“過去中國大量的臨床試驗是驗證性的試驗,重復以前的試驗驗證性的試驗PK橋接的試驗。現在中國有一千多個試驗已進行臨床一期,這些完全是探索性的試驗,完全是基礎式創新,這一點會大大改善中國以后的創新藥格局。”他談道。
2015年后,除了國家政策的支持,資本也在大力助推中國醫藥創新。2018年港股生物醫藥公司上市制度的改革與中國科創板的建立,醫藥產業創新發展的源動力得到了充分的釋放。據了解,中國生物醫藥公司在港股已經融資1200多個億,科創板迄今為止600多億,兩年時間已經遠遠超過了國家對三個十一五的計劃,金融市場推動帶來了巨大的紅利,很多公司大力布局研發創新藥。
在中康科技創新藥數據產品負責人安淑蘭看來,中國創新藥企發展模式已從獨自開荒拓土向多元化路徑縱橫發展。中國新生代創新藥企已經完成0-1原始積累,接下來將由1-100+邁進。
其中,2010年代出生的創新藥企的成長模式較上代更加靈活,他們通過獨立自主的研發,合作等多種形式實現螺旋上升直至成熟,中國創新藥企逐步將視野拓展至全球,并重視深度經營。
中國創新藥技術邁入新臺階,這當中生物藥領域或將迎來彎道超車。繼貝達成為第一個破土的拓荒者后,我國創新藥領域的技術發展也呈現快速迭代景象,從埃克替尼到安羅替尼,從PD-1到現在各種新靶點的fast-follow中國創新藥技術發展已邁入新臺階,生物藥領域或將彎道超車,中國的藥物研發已脫胎換骨展現了新面貌。
中國藥物開發進程演變

來源:中康FIC數據庫
得益于2015年的改革,此后6年,我國已建立了一套相對完整地醫藥創新生態系統。這當中,我國獲批的創新藥品種數量高速增長,歷經7年,從藥品審評審批到臨床試驗管理,我國研發端的監管體系已逐步接軌國際,趨向成熟。
中康FIC數據庫也顯示,中國創新企甚至已開始朝向“全球新”邁進,數個“全球新”藥物管線進入到了臨床階段,例如君實生物的J004,是全球首個特異性針對B和T淋巴細胞衰減因子(BTLA)的重組人源化IgG4K單克隆抗體。
在各類創新要素相互作用,良性循環,我國從醫藥創新全球第三梯隊進階到第二梯隊前列,對全球的研發管線、產品數量的貢獻約至14%,占全球排名第二。中國創新藥市場將迎來蓬勃發展,運用前景廣闊,未來可期。
從2015年的寥寥無幾,到如今14%的占比,在吳曉濱看來,照這個速度發展下去,再過幾年,中國創新藥在全世界創新藥的管線里若達到30%,這個世界局面將完全改變。
“創新藥的邏輯是先從小的適應癥有條件批準,逐漸到大的適應癥推向全球,目前中國創新制藥公司還處在早期階段。”吳曉濱介紹道,但是隨著中國創新藥的不斷發展,中國新藥一定會向國外創新藥一樣,在全球開展臨床試驗,在大的適應癥實現突破,這些創新碩果不僅會服務中國患者,也會服務于全球患者。
而行至2021年,中康科技副總裁肖淋表示,我國的醫藥產業創新發展將再次進入關鍵轉折點,快速進入并跑期,在這一階段,基于研發擁有全球知識產權的新藥研發企業將成為我國醫藥產業創新發展的領跑者。
02 同質化、內卷嚴重...中國創新藥迎新挑戰
與此同時,中國醫藥營商環境整體在發生變化。隨著帶量采購、一致性評價等醫藥政策的推進,仿制藥進入低利潤時代,也在倒逼著中國藥企做創新,進行轉型升級。在這樣的氛圍下,中國創新藥也正在面臨著一些挑戰。
據統計,中國有225家企業開展了超200余種靶點的國際化進程,而腫瘤領域占比超60%為主要趨勢,其次為感染、代謝及呼吸系統疾病。不難看到,腫瘤治療藥物是中國新藥研發的主要領域。
“大家都知道,第一個挑戰就是一窩蜂的上。”吳曉濱指出,拿腫瘤藥PD-1來說,在研的PD-1已經有幾十家,靶點扎堆,研發同質化嚴重。
針對這一現象,CDE發布了一則劍指偽創新的指導性文件。今年7月,CDE關于公開征求《以臨床價值為導向的抗腫瘤藥物臨床研發指導原則》意見的通知,引發行業熱議,對市場帶來巨大沖擊。
該文件的出臺可以說是一個轉折的標志。王如偉分析稱,可以說前十年,我國創新藥研發都是在快速跟進。在這之后,后十年中國的醫藥創新將被重新定義。當然這當中也有變與不變,他指出,以患者為中心的核心一直沒有改變。接下來,中國醫藥創新會是進一步落實以臨床價值為導向,以患者需求為核心的方向上。
他指出,PD-1靶點扎堆,高水平浪費等現象出現,原因就是在創新過程中,我們沒有真正去理解創新的要素。
“回到國際市場,我們可以看到全世界最大的藥企PD-1兩年保持100億美金,O藥也在80億左右,全球前十位的藥物銷售加起來超過1000億美金,但中國還遠遠達不到。生物藥未來十年要誕生偉大的產品和偉大的企業,結合西藥研發的特點,這里面需要我們用大量的技術、資金來支撐,還要思考如何提高效率等。”王如偉說道。
在他看來,政策方向和預期沒有改變,持續向國際一流看齊。產業創新和升級是一個長期過程,不過度解讀政策影響。該《原則》強調的是“臨床價值”和精準醫療,這當中me-too同樣具備臨床價值,如降低患者負擔和經濟學價值。此外,CDE新政長期利好創新藥頭部公司及差異化公司,CXO賽道持續看好。
而扎堆的靶點也迎來了降溫,今年已迎來可喜的變化。中康FIC數據庫顯示,在申報1類臨床的新藥靶點中,今年靶點布局集中度明顯降低,緊有1家申報的靶點占比22%,由于PD-1、EGFR等靶點因市場的過渡飽和占比有所降,CDK4/6、VEGFR、CTLA-4等相對較新靶點也未呈現擁擠現象,相較于去年冷靜許多。整體來看,創新藥靶點布局集中度降低,對靶點的技術應用更加成熟。
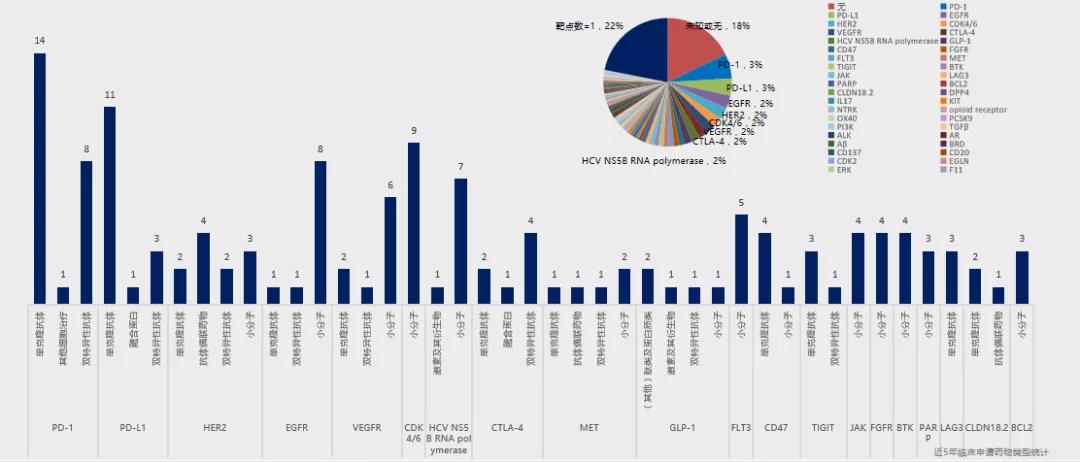
來源:中康FIC數據庫
從靶點類型來看,CD家族占比較高,其中CD47、CD137、CD20等排名靠前:在技術類型上,小分子藥物雖然是主力,但各個靶點下呈現了更加多樣化的技術發展,預示當前中國創新藥對靶點理解深度有所提升且對藥物開發的技術運用更加成熟。
除了靶點同質化問題突出,另外,中國創新藥在價格、進院等方面也面臨挑戰,價格走向何方,市場在哪里?創新藥產業如何可持續發展,進院如何打通“最后一公里”等。
靶點扎堆、適應癥競爭激烈的創新藥弊端開始突顯,用時下流行的詞來說,首個表現就是內卷,廣譜抗癌藥PD-1價格下行,有淪為普藥的跡象,恒瑞、百濟神州、君實、信達等PD-1生產企業也開始瞄準更為廣闊的市場,做全球多中心臨床試驗,出海拓展國際市場,推進商業化進程。
吳曉濱坦言,我們的創新價格已經把創新藥歐美的價格降低到了十分之一,還能夠降低多少?我們需要找到創新藥的可支付性,和老百姓可以負擔的能力,以及產業持續發展之間的一個平衡點,后續還有許多的創新藥需要進入國家醫保,這一系列的問題都是中國創新藥發展在推進當中面臨的直接挑戰。
創新藥,尤其是醫保談判之后的創新藥如何進入醫院,這一問題也在開始被逐步解決。今年,國家醫保局會同國家衛健委出臺《關于建立完善國家醫保談判藥品“雙通道”管理機制的指導意見》,確保國家醫保談判藥品順利落地,提升其保障供應水平。
安淑蘭對此也有見解,她認為,創新藥通過國談進入醫保的時間急速縮短,但也面臨價格大幅下降問題。因此,“雙循環”發展成為創新藥企業發展的必經之路。
國內市場中,創新藥通過國談進入醫保的時間極大縮短,商業化效率迅速提升,價值得以快速體現,“內循環”的效果已經顯現;國際市場,創新藥管線從幾年前的高額引進到近兩年的高額授權,亦充分體現了國際市場對中國創新藥的價值認可,“外循環”效益明顯。
楊大俊也指出,未來中國創新藥會有兩條路,一個是專利保護,一個是按照國際標準去競爭全球的市場。他表示,在生物藥競爭激烈的背景下,藥企占領先機非常重要。因此,一方面是早期要有引進,在時間差上占領中國市場;另一方面,最重要的是不斷地有中國本土的研發企業做出產品,通過海外合作加強中國醫藥研發以及提高市值。
值得一提的是,2018年中國創新藥企開始大量引進海外品種以快速建立管線格局,進而加速產品的上市;經歷了2019年的快速過渡后,這些國內生產的大批創新藥走出國門,快速、高效的實現了商業化目標。隨著國際化監管體系接軌,產品授權的的交易價格快速提升,中國創新藥也已初步受到國際認可。
7年蝶變,中國創新藥已經迎來不少碩果,進入新的轉折時期,陣痛在所難免。但中國醫藥創新的黃金時代已至,創新加速、差異化創新和全球創新的趨勢勢不可擋。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!